Contenido del Vídeo
Existen algunas moléculas que presentan lo que llamamos mesomería o resonancia, lo cual implica que no son satisfactoriamente representadas mediante una única estructura de Lewis que sea consistente con sus propiedades reales.
Por ejemplo, si tomamos en consideración la molécula de dióxido de azufre, SO2, son posibles dos estructuras de Lewis distintas:
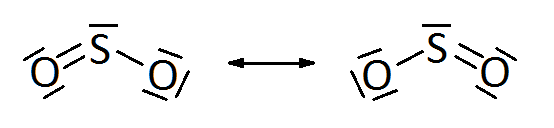
En ambas, el átomo de azufre se une con un enlace simple a un oxígeno y con un enlace doble al otro oxígeno. El enlace doble es más corto que el simple y, sin embargo, se sabe por determinación experimental que ambos enlaces azufre-oxígeno en la molécula de SO2 son idénticos y equivalentes, con una longitud intermedia entre el enlace simple azufre-oxígeno y el enlace doble.
Por ello, la molécula de SO2 tiene características intermedias entre las dos estructuras representadas. No existen dos posibles tipos de moléculas de SO2 en la realidad, sólo una, lo que sucede es que la representación de esta molécula según las estructuras de Lewis es deficiente.
Así, hay moléculas o iones, la estructura de los cuales no se puede asignar a una única distribución electrónica que explique sus propiedades de forma satisfactoria. Cada una de las representaciones recibe el nombre de fórmula límite, estas fórmulas límite no tienen existencia real, la molécula real es un estado intermedio que se denomina híbrido de resonancia o forma mesómera. Así, SO2 es un híbrido de resonancia entre estas dos fórmulas límite, lo cual se representa con una doble flecha.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente y Estructuras de Lewis.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
hola. mucho gusto me llamo neil, me gusta como explicas, dentro de poco tendrè mi examen en la universidad, hay una cosa que no entiendo no se si me podrias responder, la forma de ibrido de resonacia se forma solo cuando esa presente el oxigeno??, como el ejemplo que hiciste S02, o tambien por ejemplo SiF4 si bien con la estructura de lewis todos los àtomos llegan a completar el octeto, pero, sabemos que el Si esta en el tercer grupo y una de las reglas dice que los atomos del tercer grupo para adelante pueden tener hasta 6 copias de electrones, osea que con SiF4 se pueden formar diversas estructuras de lewis( forma limite) ?? o me equivoco, un saludo.
neil, 12 Años Antes
Hola Neil, bienvenido. Aunque el silicio pueda albergar en torno a él más de 8 electrones, no significa que deba hacerlo necesariamente. En el SiF4 el silicio formará 4 enlaces con el flúor, y por tanto tendrá a su alrededor 8 electrones, como corresponde a 4 pares electrónicos enlazantes. Cuando decimos que puede albergar más, nos referimos en este caso a que el silicio podría formar, por ejemplo, el compuesto SiF6, en el cual se enlazaría a 6 átomos de flúor y, por tanto, albergaría a su alrededor 12 electrones. En el que tú planteas, SiF4, construyes la estructura de Lewis sin formas resonantes (además, los átomos de flúor no pueden formar doble enlace porque sólo tienen un electrón desapareado en un orbital p). Espero que esto resuelva tu duda. Un saludo.
QuimiTube, 12 Años Antes
hola, entendì por que siF4 puede formar solo una estructura de lewis, pero no respondiste a mi primera pregunta, si la forma de ìbrido de resonacia se forma solo cuando esta presente el oxìgeno o no? como el ejemplo que hiciste tù, o tambièn con Co2, SO4(con aniòn -2 en el oxigeno), en todos estos ejemplos que hice, todos forman ìbrido de resonacia, si me estoy equivocando, que no solo se forma con el oxìgeno, me podrìas porfavor hacer un ejemplo de ibrido de resonancia en el que no este presente el oxigendo, disculpa por lamolestia.
neil, 12 Años Antes
¡Hola! Lamento no haberte respondido a esa pregunta. No es necesario que haya oxígenos presentes para que haya híbridos de resonancia, pero sí es frecuente que moléculas con oxígenos la presenten. Por ponerte un ejemplo de molécula que presenta resonancia pero que no tiene oxígenos te puedo poner el caso del benceno. Si miras en el siguiente enlace, en el texto de pie de vídeo, verás las dos formas resonantes del benceno a pesar de que no tiene oxígenos: http://www.quimitube.com/videos/hibridacion-sp2-con-enlaces-pi-deslocalizados-benceno/
QuimiTube, 12 Años Antes
muchas gracias! has sido muy gentil, un saludo y hasta pronto :).
neil, 12 Años Antes
Buenas me gustaria preguntarle donde se encuentran los ejercicios resueltos de este tema
Un saludo y enorahuena
Adrián, 12 Años Antes
¡Hola Adrián! Todavía no los tenemos, lo lamento. Espero que puedan llegar pronto pero me esperan unos meses de mucho trabajo y no es seguro que los pueda subir. Lo mismo sucede con termoquímica que es el tema siguiente y he visto que también me preguntabas. Cuando acabe los ejercicios de enlace me pondré con termoquímica, intentaré que sea lo antes posible. Un saludo.
Quimitube, 12 Años Antes
Buenas disculpe me gusto mucho su explicacion es bien didactica no se si lo tome a forma de critica constructica este tema de hibrido de resonancia tiene sus casos en cada molecula usted cree que pudiera hacer un video un poco mas extenso explicando mas ejemplos y problemas acerca de ello. Gracias
Alvaro, 12 Años Antes
¡Hola Álvaro! Bienvenido 🙂 Puesto que todavía no he realizado los ejercicios del tema de enlace químico intentaré que en alguno de ellos se incluyan híbridos de resonancia más complejos que los de los ejemplos para profundizar un poco más. Lo que ocurre es que todavía no sé cuándo podré grabar los nuevos vídeos y no puedo darte una estimación de lo que tardarán en llegar, pero los habrá. Un saludo y gracias por comentar.
QuimiTube, 12 Años Antes
Hola bueno, tengo que recuperar quimica y estas clases me vienen genial , pero hay una cosa que no entendí , es si la ultima capa del S es : 3s2 p4 , porque tiene un enlace dolbe con un O y con el otro no… si tubiera el doble seria en los dos seria por exceso… no? no entiendo eso…
Yenny, 12 Años Antes
Hola Yenny, realmente tú podrías plantear que el S tuviese dos dobles enlaces con el oxígeno, es decir, O=S=O, y considerar que el azufre queda con 4 pares enlazantes y con 1 par libre y, por tanto, con 10 electrones a su alrededor, ya que tiene orbitales d y esto es posible, como ocurre por ejemplo en el pentafluoruro de azufre, SF5, donde el azufre se rodea de 10 electrones. No obstante se sabe experimentalmente que los enlaces S-O de este compuesto son un poco más largos de lo esperado para dos enlaces S=O y sin embargo son idénticos entre sí. Este hecho es congruente con el planteamiento de una estructura resonante. No obstante, si tú planteas la estructura O=S=O no creo que te pongan inconveniente porque no tienes por qué tener esa información. Espero haber resuelto tu duda. Un saludo.
QuimiTube, 12 Años Antes
Hola,gracias por tu estupenda labor. He visto en otro sitio que consideran la estructura O=S=O como una tercera forma de estructura resonante para el SO2, y además indican que es la más probable teniendo en cuenta una regla que dice que entre estructuras resonantes se prefiere la que tenga menor suma del valor absoluto de las cargas formales en cada átomo. ¿Esto es compatible con el echo experimental de que el enlace S-O de este compuesto sea más largo que lo esperado para dos enlaces S=O?
Gracias
Carlos, 11 Años Antes
Hola Carlos. En efecto una estructura con dos dobles enlaces no es compatible con la estructura experimental de la molécula, aunque se podría plantear como forma resonante en un ejercicio porque de hecho, el alumno, si no se lo indican, no tiene por qué saber si la longitud de enlace S-O es más próxima a enlace simple o a enlace doble. En la entrada de wikipedia sobre el dióxido de azufre, por ejemplo, la plantean con dos dobles enlaces. Ahora bien, debes tener en cuenta que si la planteas así les falta un par libre sobre el azufre, que no han dibujado, y que es el que hace que la molécula no sea lineal sino angular. En todas las formas resonantes el azufre presenta un par libre.
QuimiTube, 11 Años Antes
Gracias, entiendo entonces que esa representación no sería la más acorde con la realidad, aunque formalmente correcta. Además al tener dos dobles enlaces y un par libre, no cumpliría la «regla del octeto», ¿eso es un problema o a veces puede haber excepciones a esta regla?
Gracias!!
Carlos, 11 Años Antes
Efectivamente, formalmente no podemos decir que sea incorrecta, ya que sí que hay excepciones a la regla del octeto. De hecho el azufre es un átomo que a menudo la incumple, porque tiene orbitales d accesibles energéticamente. Aquí tienes un vídeo sobre ello:
http://www.quimitube.com/videos/enlace-covalente-excepciones-a-la-regla-del-octeto/
QuimiTube, 11 Años Antes
me podrías proporcionar algún dato que soporte la opinión de que los enlaces S-O son más largos que los típicos dobles
Gracias
Antonio, 11 Años Antes
Hola Antonio, no tengo a mano una tabla de distancias de enlace, pero sin duda podrás encontrar una por internet o en libros y ver la distancia típica de un enlace doble S=O. Un saludo.
QuimiTube, 11 Años Antes
Hola que tal, gracias por dedicar tu tiempo con estos videos, y aquí va mi pregunta, en la estrctura de Lewis que has dibujado se muestra el azufre con solo 5 electrones en la capa de valencia cuando el azufre tiene 6 ¿verdad? Yo este compuesto lo he visto estructurado con enlace dativo ¿es posible? Y mi última pregunta es como se estructura el hiposulfito SO2^2-.
Gracias
Gonzalo, 12 Años Antes
Hola tengo que estudiar quimica inórganica y orgánica, y también las reacciones, en donde se encuentra los videos,
Gracias,
Loli
Dolores Rivero, 11 Años Antes
¡Hola Loli! ¿Tienes el temario un poquito más desarrollado? Así te podría orientar mejor. Como verás, aquí lo tenemos por temas: ácido-base, redox, termoquímica…
QuimiTube, 11 Años Antes
¡Me gusta este método de enseñanza! Son muy buenos los videos, sigan así. Saludos de Colombia *-*
Santiago, 11 Años Antes
Gracias Santiago, me alegra que te gusten 🙂 Un saludo
QuimiTube, 11 Años Antes
Hola. El ácido carbónico y el bicarbonato tienen resonancia?
verónica, 10 Años Antes
¡Hola! Aquí tienes la estructura de Lewis del carbonato que te servirá para el ácido carbónico y para el bicarbonato:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-7-estructuras-de-lewis-de-aniones-hipocloroso-nitrito-nitrato-sulfito-carbonato-y-sulfato
QuimiTube, 10 Años Antes
hola! me gustaría saber si en los enlaces triples también existe resonancia, o solamente en los dobles? Esta duda me surgió a raíz de una pregunta que dice: Cuál de los siguientes compuestos presenta mayor número de estructuras resonantes: ácido ciático, benceno o nitrometano ?
Los vídeos están buenísimos!! muchas gracias
Paula, 10 Años Antes
¡Hola Paula! Muchísimas gracias por tu comentario. Algunos compuestos con enlaces triples también podrían presentar resonancia, aunque ahora mismo no se me ocurre ningún ejemplo… Es más frecuente encontrarla en enlaces dobles. Siempre que puedas plantear movimientos de pares electrónicos sin necesidad de romper enlaces tendrás estructuras resonantes válidas. Un saludo grande.
QuimiTube, 10 Años Antes
Hola, disculpa quisiera saber que tipo de enlaces presenta una reacción ácido bases, por ejemplo que tipo de enlace presenta el bicarbonato de sodio, con el ácido acético, y lava trastes?, también quería que me ayudaras diciéndome 3 experimentos sencillos de enlaces,
Jesús Dominguez, 10 Años Antes
Hola Jesús. Depende. El bicarbonato sódico, por ejemplo, es un compuesto iónico formado por cationes Na+ y aniones HCO3-. Así, entre estos iones el enlace es iónico, pero en el propio bicarbonato, HCO3-. el carbono y los oxígenos están unidos entre sí mediante enlace covalente. Cuando se produce la reacción:
NaHCO3 + CH3COOH –> CH3COONa + H2CO3
Se forma el acetato de sodio, que le ocurre lo mismo que antes. Es iónico formado por CH3COO- y Na+, pero en el anión CH3COO- el enlace de los distintos átomos es covalente.
No se me ocurren los experimentos sobre enlace, tal vez algo de solubilidad. ¿Has mirado algún libro de prácticas de laboratorio?
Un saludo grande
QuimiTube, 10 Años Antes
Buenas tardes antes que nada quisiera agradecerle por las clases me sirvieron de mucho y entendi muchos temas asi que gracias. Le envio este mensaje para que pueda evaluar si subir clases sobre el tema «NOMENCLATURA» ya que es un tema fundamental en la quimica y a mi en particular me serviria de mucho ya que e leido libros y demas y aun asi no logro entenderlo, desde ya muchas gracias por la atención.
Matias, 10 Años Antes