Contenido del Vídeo
En este ejercicio de enlace químico vamos a determinar la estructura de Lewis de la molécula de fosgeno, COCl2, así como la hibridación que presenta el átomo central y a estudiar algunos parámetros de enlace, como por ejemplo la distancia de enlace y el ángulo.
El enunciado es:
El fosgeno, COCl2, es un gas tóxico usado en múltiples aplicaciones industriales, que también se usó como arma química en la Primera Guerra Mundial. ¿Qué hibridación presentará el átomo central y qué geometría? ¿Serán las distancias y ángulos de enlace iguales en todos los casos?
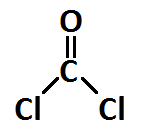
En el caso de las distancias de enlace, serán distintas porque un enlace doble será más corto, en general, que un enlace simple. Además, el oxígeno es un átomo menos voluminoso que el cloro, por lo que incluso el enlace simple C-O será más corto que el enlace C-Cl, cuando más el doble enlace C=O.
En cuanto a los ángulos de enlace, la densidad electrónica del doble enlace C=O es mayor que la de los enlaces C-Cl, esto hará que ejerza una mayor repulsión este enlace sobre los vecinos, por lo que dichos enlaces C-Cl se cerrarán más y este ángulo, en lugar de los 120º esperables por la hibridación sp2 del carbono y la geometría plana trigonal, es de 112º.
También te puede interesar:
Determinar la geometría de algunas moléculas por RPECV e hibridación
Determinar el tipo de hibridación de los átomos de una molécula orgánica
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Enlace covalente y Geometría molecular e hibridación.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Muy buena explicación profesora, usted me ha ayudado a entender este tema que se me hacia dificultoso. Gracias.
lucero, 11 Años Antes
Hola de nuevo Carmen, tengo una duda de esas que no se deben hacer a ultima hora:
Es a la hora de «predecir» la estructura molecular de algunas moléculas.Siguiendo tu método la mayoría salen bien pero hay otras que no sé que estoy haciendo mal. Por ejemplo:
AsF5:Tenemos 40e y necestaríamos llegar hasta los 48. 48-40=8/2 =4 pares enlanzantes. 40-8=32/2=16 pares no enlazantes.
¿Como es que tengo 4 pares si tengo que enlazar 5 átomos de flúor al As?. Al final sé que tengo una geometría octaédrica (piramidal cuadrada), pero si lo hago siguiendo el método, no paso de los 4 pares :-S
Me pasa lo mismo con AsF3 con IF4+ ..
¿Podrías ayudarme a saber que pasa?
Muchísimas gracias por todo.
Juan G., 10 Años Antes
¡Hola! Efectivamente esto te puede ocurrir con estructuras que no siguen la regla del octeto porque los átomos centrales pueden albergar más de 8 electrones (o menos, en algunos casos). Te sugiero ver estos vídeos:
http://www.quimitube.com/videos/enlace-covalente-excepciones-a-la-regla-del-octeto
http://www.quimitube.com/videos/ejercicio-enlace-quimico-4-estructuras-de-lewis-de-algunas-moleculas-covalentes-sencillas-sin-resonancia
En el segundo vídeo, el ejercicio resuelto, verás excepciones como el SF6 o el BeCl2.
Un saludo.
QuimiTube, 10 Años Antes