Contenido del Vídeo
La molécula de benceno, de fórmula C6H6, es una molécula cíclica plana cuya estructura de Lewis se puede representar como:
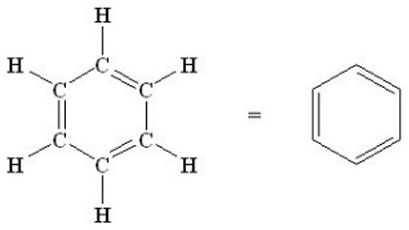
Como vemos, según esta representación, tendría 3 enlaces dobles carbono-carbono y tres enlaces simples. No obstante, experimentalmente se sabe que, en efecto, la molécula de benceno es plana, los ángulos son de 120º y los 6 enlaces carbono-carbono son idénticos y presentan propiedades intermedias entre un enlace doble y un enlace simple, siendo la distancia de enlace de 0,142 nm (la de un enlace simple es de 0,152 nm y la de un enlace doble de 0,134 nm). Por este motivo, el benceno se suele representar como:
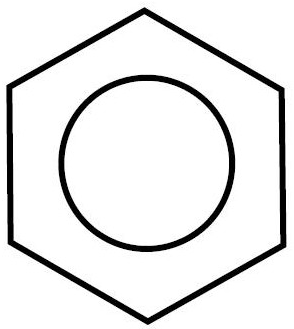
Omitiendo, además, los átomos de hidrógeno. Esto indica que es un híbrido de resonancia, una «mezcla» entre dos estructuras posibles (puedes ver el vídeo sobre mesomería o resonancia):
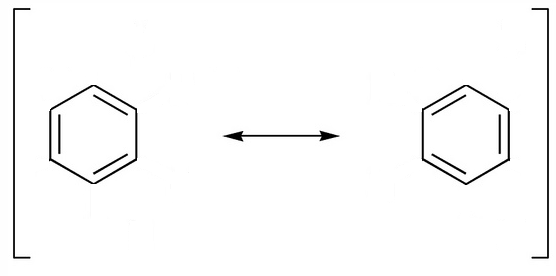
El benceno presenta unas características propias distintas a los alcanos y alquenos, y que recibe el nombre de carácter aromático o aromaticidad. El hecho de que la molécula sea plana, los ángulos de 120º y todos los enlaces iguales, se puede justificar considerando una hibridación sp2 de los 6 átomos de carbono, pero con enlaces pi deslocalizados. Es decir:
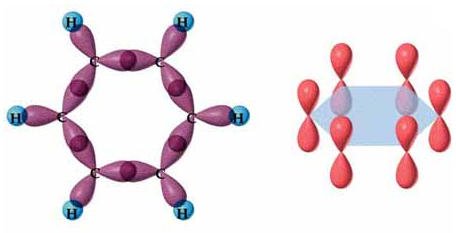
Como se puede observar, cada átomo de carbono tiene 3 orbitales híbridos sp2 colocados en un plano y dirigidos a los vértices de un triángulo equilátero, y un orbital p sin hibridar, semiocupado, perpendicular al plano de los híbridos. En total la molécula tiene 6 orbitales p que solaparán entre sí lateralmente, formando un sistema de enlaces pi deslocalizados, es decir, la densidad electrónica se distribuye de forma simétrica por encima y por debajo del plano:
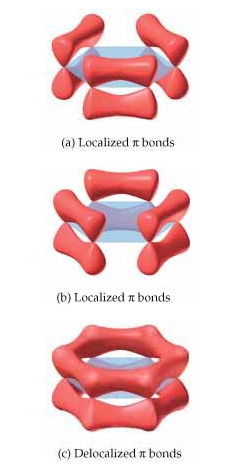
En la imagen de pueden ver lo que serían los enlaces localizados, tal y como se podía plantear en las dos estructuras resonantes del benceno, y la realidad, en la que se trata de 6 enlaces intermedios simple-doble, los llamados enlaces pi deslocalizados.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente, Geometría molecular e hibridación y Modelo enlace de valencia.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Información Bitacoras.com…
Valora en Bitacoras.com: La molécula de benceno, de fórmula C6H6, es una molécula cíclica plana cuya estructura de Lewis se puede representar como: Como vemos, según esta representación, tendría 3 enlaces dobles carbono-carbono y tres enlaces simples…..
Bitacoras.com, 13 Años Antes
Holaaa ! Muchisimas gracias por subir videos tan bien explicados de verdad, me estan ayudado mucho con esta asignatura que tanto me cuesta, unna vez mas gracias y sigue asi !!
Blanca, 13 Años Antes
¡Hola Blanca! Bienvenida 🙂 Me alegro de que te sirvan y que te ayuden con la asignatura. Espero que al final te llegue a gustar, no es tan mala como la pintan jeje. Un saludo grande.
QuimiTube, 13 Años Antes
excelente la verdad entendi a la perfeccion gracias
Natan Eliu González Banda, 12 Años Antes
¡Mil gracias por comentar! Me alegro mucho de que te sirviera 🙂 Un saludo grande
QuimiTube, 12 Años Antes
Hola, una duda, ¿a caso toda molécula, con enlaces deslocalisados que formen un enlace intermedio, es una molécula aromática?, ¿es válida la afirmación recíproca?. Gracias.
Ivan, 12 Años Antes
Genial! Gracias por estos vídeos! Así sí! 😀
Rocío, 12 Años Antes
¡De nada! Gracias a ti por comentar, Rocío.
QuimiTube, 12 Años Antes
Buenas tardes , si a esta molécula de benceno se la hidrogena con dos moléculas de hidrógeno , se formaría ciclohexeno . Los enlaces del ciclohexeno siguen siendo todos iguales ,de la misma longitud que en el benceno ? o ahora ya no sería resonante y los carbonos tendrían 5 enlaces simples y uno doble ?? muchas gracias por los vídeos . Un saludo
sergio, 12 Años Antes
¡Hola Sergio! Creo que ya te he respondido por e-mail, espero que te haya servido mi respuesta. Un saludo.
QuimiTube, 12 Años Antes
En los enlaces deslocalizados, los electrones del enlace pi ¿van circulando por todo el anillo?
Rubén, 12 Años Antes
Hola Rubén, sí, podemos considerarlo de este modo, por este motivo todos los enlaces son equivalentes entre sí.
QuimiTube, 12 Años Antes
Entonces, no se trata de un doble enlace propiamente dicho no? Por estar ahí los orbitales Py sin hibridar hace que la longitud de enlace sea diferente a la que se daría con C-C y eso le da el carácter aromático.
Las estructuras resonantes son todas así (que tienen esos orbitales perpendiculares sin hibridar que hacen que esten deslocalizados los dobles enlaces……) ??
Muchísimas gracias!! No sabes cuánto te agradezco que hagas estos vídeos, hace falta más gente como tu en este mundo^^
Javi, 11 Años Antes
Hola Javi, efectivamente la resonancia hace que los enlaces presenten características intermedias entre los dobles y los simples. Generalmente es así, las estructuras resonantes siempre se dan en moléculas que presentan orbitales p sin hibridar contiguos en más de dos átomos.
Muchas gracias por tu comentario, me anima mucho 🙂 Un abrazo.
QuimiTube, 11 Años Antes
muchas gracias, sin esta explicación, yo no sabría de que decir en mi exposición de química 🙂
sahara wendoline, 11 Años Antes
¡Mucha suerte en tu exposición!
QuimiTube, 11 Años Antes
Tenes algun video explicando hibridacion en moleculas donde no se cumpla el octeto? por ejemplo no le puedo encontrar vuelta al trioxido de azufre, al exitar el electron del 3S va al orbital d?
Matias Schefer, 11 Años Antes
¡Hola! Lo lamento, no tenemos nada porque este contenido que comentas lo consideramos de nivel universitario y de momento solo llegamos a preuniversidad.
QuimiTube, 11 Años Antes
Hola muchas gracias por los videos,la verdad me sirvieron muchisimos,sos una genia.Ha y muy hermosa tambien.Saludo.
Sebastián, 10 Años Antes
¡Muchas gracias Sebastián! Bienvenido. Un saludo.
QuimiTube, 10 Años Antes
cuantos orbitales sp2 tiene el benceno?..6?
danielagonzalez, 10 Años Antes
Cada carbono tendrá 3 (combinación de un s y 2p de cada carbono, para dar 3 híbridos sp2). Dos de ellos los usa para unirse a los carbonos adyacentes con enlace sigma y luego cada uno de ellos tiene un sp2 perpendicular al plano del anillo, como verás en el dibujo a pie de vídeo.
QuimiTube, 10 Años Antes
gracias, me sirvió mucho el vídeo y muy buena la explicacion.
yuliana, 10 Años Antes
Muchas gracias, un saludo.
QuimiTube, 10 Años Antes
[…] http://www.quimitube.com/videos/hibridacion-sp2-con-enlaces-pi-deslocalizados-benceno […]
BENCENO – Título del sitio, 8 Años Antes
muy buena explicacion
neri, 7 Años Antes
BUENOS DIAS POR FAVOR ME COLABORAN CON UNAS PREGUNTAS DE QUIMICA
EXPLICA BREVEMENTE POR
MARISOL, 7 Años Antes
Disculpa me puede responder está pregunta, por favor¿Por qué se afirma que el benceno es un hídrido de resonancia?
Wuilianny Contreras, 5 Años Antes
¡Hola! Como puedes ver en la explicación el benceno es un híbrido de resonancia porque es una estructura intermedia entre otras dos estructuras, de modo que todos los enlaces tienen la misma longitud.
QuimiTube, 5 Años Antes
El fenómeno de hibridacion se presenta en los enlaces del benceno y está muy relacionado con sus formas de resonancia. Describe la relación que se establece entre la hibridacion y las formas de resonancia. Representa las dos formas de resonancia del benceno y la de su híbrido.
lucia, 5 Años Antes