Contenido del Vídeo
Existe un tipo especial de enlace covalente en el cual, en lugar de aportar un electrón cada átomo del enlace, los dos electrones son aportados por el mismo átomo. Este tipo de enlace recibe el nombre de enlace covalente coordinado o enlace covalente dativo.
También se puede representar el enlace covalente coordinado con los diagramas o estructuras de Lewis, aunque es habitual hallarlo, adicionalmente, encerrado entre corchetes, dado que habitualmente se trata de iones poliatómicos.
Dos ejemplos de iones habituales que presentan enlace covalente coordinado son el ion hidronio o hidrogenión (H3O+, el que se forma cuando un ácido cede su protón, H+, en agua) y el catión amonio, NH4+ (que es el resultado de que el amoníaco se comporte como base captando un H+).
Evidentemente, si a un átomo de H, cuya configuración electrónica es 1s1, le quitamos el único electrón que tiene para dar el ion hidrógeno o protón, H+, no le quedan electrones con los que formar enlace covalente simple, por lo que la única opción que le queda es formar un enlace covalente coordinado en el cual los dos electrones sean aportados por otra especie. De este modo, esta otra especie debe, necesariamente, disponer de pares de electrones libres o no enlazantes.
Así, el ión oxonio, H3O+, resulta de la adición de un H+ a una molécula de agua, H2O. La estructura de Lewis del ion hidronio es:
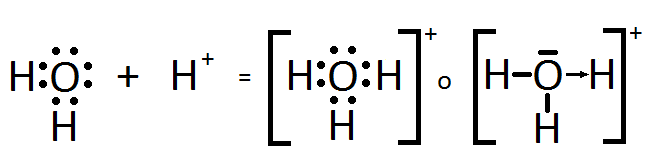
Mientras que el ion amonio, NH4+, resulta de la adición de un H+ a una molécula de amoníaco, NH3. La estructura de Lewis del ion amonio es:

Tal vez también te interese:
Geometría e hibridación del ión oxonio, H3O+, y del ión amonio, NH4+
El enlace covalente, la regla del octeto y las estructuras de Lewis
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente y Estructuras de Lewis.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
me gusto mucho la explicación pero hay algo que no entiendo por que el hidrógeno pierde su electrón y queda en positiva
david, 13 Años Antes
Hola David, bienvenido. Esto sucede cuando tenemos un medio ácido, es decir, una especie química formada por H+ y otro anión, como por ejemplo el ácido clorhídrico, HCl. Este ácido se disocia dando H+ en el agua, y después el agua puede captar un H+ para dar H3O+ o, si lo que disuelves es amoniaco, NH3, puede captar el H+ para dar NH4+. Si el pH no es ácido (inferior a 7) tendrás algunos H3O+ en el agua, pero en concentración muy muy pequeña. Un saludo.
QuimiTube, 13 Años Antes
Ayer me pasé la tarde entera en la biblioteca de facultad de ciencias. Gracias, muy bien explicado.
Mi pregunta es: así como en el resto de enlances dan nuevas sustancias, moléculas: Por ejemplo el H2 es gas tiene sus puntos fusión diferentes de O2 y que de H2O.
Los iones? H3O+ NH4+ [HbO2] ( con sus 6 enlaces de dación o coordinación, ¿Son otras sustancias diferentes?
Gracias por tiempo.
Atte
simon, 13 Años Antes
Supongo que te refieres a si son sustancias distintas al agua y al amoníaco. Podríamos decir que sí, que las propiedades del H3O+ y del NH4+ son distintas de los compuestos de los que proceden, por ejemplo el catión amonio, NH4+, incluso puede formar redes iónicas, como el cloruro de amonio o el nitrato de amonio (conocido por ser un abono y un precursor de explosivos como el amonal). No obstante, cuando tienes H3O+ y NH4+ en agua estarán en equilibrio ácido base con la disolución (como verás en el tema de ácido base) por lo que la interconversión de H3O+ a H2O y de NH4+ a NH3 en disolución es sencilla dependiendo del pH.
Espero haber resulto tu duda.
Un saludo y mucha suerte con tus estudios 😀
QuimiTube, 13 Años Antes
Como se representa en una hibridacion el enlace dativo de una molecula como SO3.
Fabiola, 13 Años Antes
Hola Fabiola, bienvenida, lo siento, no acabo de entender bien la pregunta, ¿te refieres a cómo se dibujaría un orbital híbrido para el SO3? ¿O a qué tipo de hibridación presenta?
QuimiTube, 13 Años Antes
buena explicacion …… peor me queda una duda. Estos enlaces covalentes dativos solo pueden realizarse con iones de hidrogeno???
george, 12 Años Antes
Hola George, bienvenido. No, el enlace covalente dativo no se da únicamente con protones, se puede dar con más sustancias. De hecho, cualquier sustancia que tenga un par libre de electrones, como el amoníaco, se puede comportar como una base de Lewis y formar un enlace dativo con una molécula capaz de aceptar dicho par electrónico, es decir, de comportarse como ácido de Lewis. No obstante, no se trata de enlaces tan comunes como los covalentes normales. A lo largo de la semana que viene colgaré los vídeos de ejercicios y veremos algunos compuestos en los que se puede plantear enlace covalente dativo. Un saludo y gracias por comentar.
QuimiTube, 12 Años Antes
Hello!
XeO2F2 haber si me puedo explicar esta molecula tiene Geometria See-Saw/Balancin entonces tiene 4 enlaces y 1 par de e- libre. Mi pregunta es sobre los enlaces, esta molecula tiene 2 enlaces dativos? porque las formulas que he visto siempre sale con enlaces dobles al oxigeno pero eso quiere decir que el Xe va a tener 14 e- alrededor? pero si tiene (creo yo) dos enlaces dativos entonces si tendria solamente 8 e- ?? por favaaaa algun comentario??
Dayana, 12 Años Antes
hola!
quería preguntar si existe alguna forma de saber de antemano si en la molécula hay enlaces covalente cordinado, solo para ahorrar tiempo intentando con los simples, dobles o triples. Muchas gracias.
Leonardo, 12 Años Antes
Hola Leonardo, bienvenido. No, no se me ocurre ninguna forma de saber de antemano si tendrá covalente coordinado salvo por estar habituado a la estructura en concreto, lo siento.
QuimiTube, 12 Años Antes
Porque se dan las moleculas H+?
Kelly, 12 Años Antes
¡Hola! Los H+ son los iones procedentes de los ácidos, en un medio ácido siempre vas a tener una concentración alta de H+, incluso habrá H+ en agua neutra (siempre hay una cierta concentración de ellos en el agua), y puede formar enlace con especies como el NH3 para dar NH4+ o una molécula de agua completa para dar H3O+.
QuimiTube, 12 Años Antes
tengo una pregunta , como se mostraria un compuesto como el hidroxido de sodio
Na(OH)
alvaro, 12 Años Antes
¡Hola! No sé muy bien a qué te refieres con mostrar, ¿a cómo se escribiría? Basta que pongas NaOH, no importa el paréntesis…
QuimiTube, 12 Años Antes
Bueno antes que nada que guapa, 😉 Pero bueno necesito las propiedades de un enlace covalente coordinado es decir: Si son solubles en solventes polares , si conducen la corriente eléctrica,si lo encuentro en los 3 estados de la materia !! Ayuda es para mi tarea !!
Edgark, 12 Años Antes
Hola Edgark, gracias 🙂 Pues depende del compuesto en sí, ya que hay especies que presentan enlace covalente coordinado que son iónicas, como el NH4+, y esto hará que sean solubles en agua, por ejemplo. No obstante, en general, si el compuesto es neutro y tiene enlace covalente coordinado sus propiedades serán muy similares a si tiene enlace covalente «normal», dependiendo de la geometría de la sustancia y de su polaridad.
QuimiTube, 12 Años Antes
Muchas gracias por la explicación y por la página en general, creo que a más de uno nos estás ayudando mucho.
Una duda: ¿podrías decirme algún compuesto más que tenga enlace coordinado o dativo?
Alejandra, 12 Años Antes
¡Hola Alejandra! Me alegro mucho de que te sirva 🙂 En cuanto a otros compuestos con enlace coordinado o dativo suelen ser iones complejos que no se tratan en bachillerato, en los cuales un metal de transición se coordina con una serie de ligandos que presentan pares libres en su estructura, como amoníaco, monóxido de carbono, agua… Pero como te digo no entra en bachillerato, aunque aquí en este artículo tienes algunos ejemplos: http://es.wikipedia.org/wiki/Complejo_(qu%C3%ADmica)
Como verás son realmente complejos. Un saludo.
QuimiTube, 12 Años Antes
Una pregunta un enlace covalente coordinado es tan furte como un enlace covalente normal??
dessire, 12 Años Antes
¡Hola! Depende del enlace en sí, pero es cierto que hay enlaces covalentes coordinados con una fortaleza bastante grande, no suelen ser enlaces muy débiles.
QuimiTube, 12 Años Antes
ola tengo una duda no entiendo esta parte me la podrias aclarar :
cuales son los tipos de enlace porque encuentro enlace polar
, no polar, apolar ,dativo o coordinado porafovr ayudame
carlos, 12 Años Antes
Hola Carlos, los tipos de enlace son tres: enlace covalente, enlace iónico y enlace metálico.
QuimiTube, 12 Años Antes
gracias pero me refiero a los tipos de enlaces covalente encuentro
estos dime cuales son sinonimos y sus diferencias de electronegatividades de cada uno porfavor :
enlace covalente :
polar
no polar
,puro
apolar ,
coordinado
carlos, 12 Años Antes
estos son los enlaces que encuentro dime cuales son sinonimos y sus diferencias de electronegatividades :
enlace covalente : polar , no polar , puro ,apolar , coordinado
carlos, 12 Años Antes
Todos esos que comentas son diferentes tipos de enlaces covalentes. En cuanto al tema de diferencia de electronegatividad te sugiero que veas el vídeo relativo a polaridad de enlace y polaridad molecular, en nuestros vídeos encontrarás todas las explicaciones.
QuimiTube, 12 Años Antes
gracias me sirvio de mucha ayuda C:
sabes donde puedo encontrar ejemplos de enlace metalico pero que se expliquen utilizando la estructura de lewis es un trabajo que me dejaron
carlos, 12 Años Antes
Eso que comentas me resulta muy raro, ya que las estructuras de Lewis se utilizan exclusivamente para explicar los enlaces covalentes… Tal vez te refieras a la teoría del mar de electrones para el enlace metálico: http://www.quimitube.com/videos/introduccion-al-enlace-metalico-modelo-del-mar-de-electrones-o-del-gas-electronico/
Abajo verás un dibujo que tal vez sea lo que estés buscando.
QuimiTube, 12 Años Antes
hola su tarea me a servido de mucha ayuda
neyla cnedo, 12 Años Antes
Gracias, me alegro mucho 🙂
QuimiTube, 12 Años Antes
tengo una duda, como puedo encontra donde se iso en enlase dativo en estos elementos HNO3
rogger, 12 Años Antes
Disculpe el d.E del enlace covalente ¿Cuánto es?
Paola, 12 Años Antes
¡Hola! ¿Te refieres a la distancia de enlace? ¿O a la diferencia de energía? En todo caso no es fijo para ningún enlace covalente, depende de qué átomos se estén enlazando.
QuimiTube, 12 Años Antes
¿Qué no en el enlace covalente se comparten los electrones?
Héctor, 12 Años Antes
Hola, no entiendo bien tu pregunta. ¿Quieres decir si en el enlace covalente se comparten electrones? Sí, es un enlace por compartición electrónica, aunque en el covalente dativo los dos electrones son aportados por el mismo átomo, mientras que en el enlace covalente «normal» procede un electrón de un átomo y otro del otro átomo para formar el par enlazante.
QuimiTube, 12 Años Antes
no encontre lo que queria
jessica, 12 Años Antes
Lo lamento, ¿qué estabas buscando exactamente? Un saludo
QuimiTube, 12 Años Antes
muy bien explicado, me sirvio mucho para aclarar algunas ideas.
felicitaciones. 🙂
nissa, 12 Años Antes
Me alegra que te haya servido. Un saludo grande.
QuimiTube, 12 Años Antes
quimitube una pregunta los enlaces dativos tambien son impresindibles a la hora de calcular la hibridacion de la molecula?
giam pierrs, 12 Años Antes
Muy bien explicados los temas, en donde encuentro màs ejercicios
Martha Peña, 12 Años Antes
¡Hola Martha! Estos son todos los ejercicios que hay de enlace químico:
http://www.quimitube.com/ejercicios-de-enlace-quimico/
QuimiTube, 12 Años Antes
me gusto mucho la publicacion por que habla del enlace cobalente coordinado
olga gomez, 12 Años Antes
Gracias Olga, me alegra que te sirviera.
QuimiTube, 12 Años Antes
Y si tengo: SF6 como me quedaria! Por favor me ayudan
yuliana, 11 Años Antes
¡Hola! En este vídeo sale: http://www.quimitube.com/videos/ejercicio-enlace-quimico-4-estructuras-de-lewis-de-algunas-moleculas-covalentes-sencillas-sin-resonancia/
QuimiTube, 11 Años Antes
Eres una máquina, de verdad, mil gracias por tu web, sigue así.
Ernesto, 11 Años Antes
¡Muchas gracias!
QuimiTube, 11 Años Antes
muy buen aporte, entonces son 3 enlaces covalentes y 1 dativo verdad?, desde ya muchas gracias
Walter, 11 Años Antes
¡Hola! Sí, 3 covalentes «normales» y un enlace dativo. Un saludo.
QuimiTube, 11 Años Antes
q bien
juan, 11 Años Antes
psss esta pagina me sirvio mucho pero no del todo porque no hay buena organizacion de la informacion
gabriela, 11 Años Antes
¡Hola! Hemos intentado organizar la información tal y como se da en el curso de segundo de bachillerato de España, quizá por ello pueda no coincidir con los contenidos que buscas. Por supuesto se aceptan sugerencias de mejora para organizarla de forma que os pueda resulta más útil, que es el objetivo. Un saludo grande.
QuimiTube, 11 Años Antes
El O es 2s2 2p4 no?
Andrés, 11 Años Antes
Que tipo de enlace es el ozono?
Ivanna, 11 Años Antes
¡Hola! Aquí tienes más sobre el ozono y su estructura. El enlace es covalente.
http://www.quimitube.com/el-ozono-o-a-que-huelen-las-tormentas
QuimiTube, 11 Años Antes
TE AMO ESPAÑOLA!!, SOS UNA GENIA!!, HACES QUE ENTIENDA EL TEMA A LA PERFECCIÓN, ESTOY FELIZ CON TUS VIDEOS Y TUS EXPLICACIONES, 😀
MILES DE GRACIAS!!!!, Y SALUDOS DESDE ARGENTINA, ^^
Fiorella, 11 Años Antes
¡Muchas gracias Fiorella! Me alegra muchísimo que te sirvan 😀 Un abrazo hasta Argentina y mucha suerte con tus estudios.
QuimiTube, 11 Años Antes
Alguien puede explicarme porque el nitrógeno, puede aceptar el Hidrógeno para formar el ion amonio si éste ya tiene llena su última capa con 3 electrones, y de paso ¿por qué algunos elementos pierden electrones y a donde van a dar estos?
Aldo, 11 Años Antes
Hola Aldo. El hidrógeno no tiene su capa completa, al contrario, H+ no tienen ningún electrón, es un protón solo y tiene cabida para 2 electrones que le cede el nitrógeno. Los electrones que el nitrógeno «presta» son los dos del par libre que tiene sobre sí mismo. Te recomiendo ver el vídeo con detenimiento, ahí está mejor explicado.
En cuanto a la cesión de electrones siempre tiene que dárselos a otro átomo, los electrones no quedan «volando», siempre se trata de una transferencia y si no hay nadie a quién dárselos no se forma el ión.
QuimiTube, 11 Años Antes
Tengo la siguiente pregunta en un curso que debo dar:
«Represente las estructuras de Lewis de las siguientes moléculas covalentes, cada una de las cuales tiene uno o más enlaces covalentes coordinados:
a) HClO4.»
Si pudieras responderme esa duda porfavor, de antemano gracias
Agustin, 10 Años Antes
Hola de nuevo. Esta estructura se puede plantear con enlaces covalentes coordinados o sin ellos. Nosotros la hemos planteado sí, pero será muy similar a como la planteamos aquí:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-6-estructuras-de-lewis-de-los-oxoacidos-del-cloro
QuimiTube, 10 Años Antes
hola bueno en un mes tengo un examen y me gustaria entender un poco mas el enlace covalente coordinado no comprendo siempre que un elemento se quede sin electrones cargandose positivamente tendra que unirse a otro o sea que siempre pasa asi? respondan pronto gracias
lupis, 10 Años Antes
Hola, no es exactamente que quede un elemento con carga positiva, la carga positiva es globalmente del ion que ves en los ejemplos, como NH4+ o H3O+.
QuimiTube, 10 Años Antes
Hola me encantas tus videos son muy buenos.
Tenia una consulta, ¿cual es al relación entre la interacción ion-dipolo y el enlace dativo ?
El motivo de mi pregunta es por que el amoniaco en el modelo de dipolos este se modelaría como un dipolo permanente mientra que el ion hidrógeno seria un catión, produciéndose una interacción ion-dipolo que me parece que tiene algo que ver con el enlace dativo…
Espero tu respuesta…
Gracias
Jorge Chumbipuma, 10 Años Antes
Hola Jorge, cuando tú tienes una disolución con NH4+ y NH3, efectivamente se producirán interacciones ion dipolo entre ambas especies. No es que haya una relación directa entre dicha interacción y el enlace dativo, si bien sí que es cierto que si el NH4+ tiene carga neta positivas (es un catión) se debe a dicho enlace, pero una cosa son los enlaces intramoleculares (en el interior de la propia molécula, como el dativo) y otra los intermoleculares (entre distintas moléculas, como la interacción ion-dipolo). Un saludo.
QuimiTube, 10 Años Antes
Quiero un ejemplo de enlace coordinado y como explicarlo en clases es exposición
Lizbeth, 10 Años Antes
Lo tienes en el vídeo Lizbeth, un saludo.
QuimiTube, 10 Años Antes
Muy buena su explicación. Clara y con contenido
Angelica, 10 Años Antes
¡Muchas gracias!
QuimiTube, 10 Años Antes
Hola buenísima página,podrías decirme si tienes algo sobre sobre soluciones
Ld, 9 Años Antes
¡Hola! Lo siento sobre soluciones todavía no tenemos nada. Gracias por tu comentario. Un saludo.
QuimiTube, 9 Años Antes
Buenísima pàgina,excelentes vídeos.Tienen página de facebook y consulta de dudas?
Christian, 9 Años Antes
¡Hola! ¡Muchas gracias! Sí tenemos página de Facebook (http://www.facebook.com/quimitube) pero a través de ahí no resolvemos dudas, solo en los comentarios. Un saludo.
QuimiTube, 9 Años Antes
Hola! tengo una duda. por que la molécula de ion hidronio queda con +? no es que para tener carga + le deben faltar electrones?
Nicolas, 9 Años Antes
Hola! Queda con carga positiva porque es el resultado de la unión entre una molécula de agua y el ion H+, es decir, un átomo de hidrógeno que ha perdido el electrón, de modo que efectivamente tiene defecto de electrones y por eso es un catión.
QuimiTube, 9 Años Antes
Y cuando el ión amonio se une con el NO3, ¿cómo permanecen unidos?¿Se trata solo de atracción electrostática?¿Quién cede electrones a quién?¿Por qué el NO3 tiene carga negativa? Gracias de antemano por su ayuda.
PD: Adoro este sitio web.
Valentino, 9 Años Antes
Hola Valentino, en efecto el compuesto NH4NO3 es simplemente un compuesto iónico en el que tienes dos iones, los cationes amonio, NH4+, de carga positiva, y los aniones nitrato, NO3-, de carga negativa. Por tanto, forman una red que se mantiene unida por atracción electrostática (enlace iónico). Un saludo grande y gracias por tu comentario.
QuimiTube, 9 Años Antes
Tengo una pregunta cuales son las reglas a seguir del enlace covalente cordinado
Ángel Peña, 5 Años Antes
Hola Ángel, no entiendo bien tu pregunta, el enlace covalente coordinado lo explicamos precisamente en este vídeo. ¿Tienes alguna duda un poco más concreta? Un saludo.
QuimiTube, 5 Años Antes