Contenido del Vídeo
Generalmente, cuando se modifica la presión de un sistema en equilibrio a temperatura constante, el sistema deja de estar en equilibrio y necesita reajustarse para volver a alcanzarlo. Del mismo modo, si modificamos el volumen también modificamos la presión y por tanto el sistema también deja de estar en equilibrio. Para modificar la presión de un sistema podemos introducir un gas inerte a volumen constante (lo cual no varía el equilibrio químico porque no varía las presiones parciales de los compuestos que intervienen en el mismo) o podemos variar al volumen del recipiente.
Si variamos el volumen del recipiente también varía la presión ya que:
P·V = n·R·T
Son magnitudes inversamente proporcionales, de forma que al aumentar el volumen disminuye la presión y viceversa.
Considerando el siguiente equilibrio químico:
N2(g) + 3H2(g) ⇔ 2NH3(g)
Se cumplirá que:
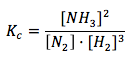
Si reducimos el volumen a la mitad, se duplicarán las concentraciones de las especies con respecto a las del equilibrio. Así:
[N2] = 2[N2]e
[H2] = 2[H2]e
[NH3] = 2[NH3]e
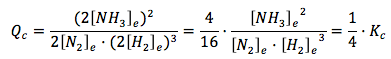
Como vemos, Qc ya no es igual a Kc, el sistema ha dejado de estar en equilibrio al variar el volumen y debe evolucionar para recuperarlo. Como Qc < Kc, el sistema evolucionará hacia la derecha, hacia la formación de más NH3. Lo que ocurre es que, al aumentar la presión, el sistema se desplaza en el sentido en el que hay menos moles de gas. A la izquierda de la reacción hay 4 moles de gas (1 de N2 y 3 de H2) y a la derecha hay 2 moles de gas (2 de NH3). En general:
- Un aumento de la presión (o disminución del volumen) provoca que el sistema evolucione en el sentido en el que hay menos volumen, es decir, donde el número de moles gaseosos es menor.
- Una disminución de la presión (o aumento del volumen) provoca que el sistema evolucione en el sentido en el que hay más moles, es decir, donde el número de moles gaseosos es mayor.
Así, en el caso de la reacción del amoníaco:
Si ↓V o ↑P, la reacción se desplaza hacia la derecha
Si ↑V o ↓P, la reacción se desplaza hacia la izquierda
Ahora bien, cabe destacar que, si en un equilibrio químico tenemos el mismo número de moles a la izquierda y a la derecha, una variación de la presión o del volumen no afectará al equilibrio químico. Por ejemplo:
N2(g) + O2(g) ⇔2NO(g)
También te puede interesar:
Equilibrio Químico 7.1. Principio de Le Châtelier: modificación de la concentración
Category: Equilibrio Químico, Teoría de Equilibrio Químico y Vídeos Equilibrio Químico.
Etiquetas: Principio de Le Châtelier.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
hola buenas.
mi pregunta es si al reducir la mitad el volumen doblamos la concentracion de los R y P, los coeficientes estequiometricos serian el doble 2N2 + 6H2 —— 4 NH3. y no los 4/16,deberia de ser el doble que en equilibio.
y tampoco se porque Qc= 1/4 Kc
enrique, 10 Años Antes
Hola Enrique, el ajuste de la reacción no depende de qué cantidad tengamos en el recipiente, sino únicamente de qué reactivos y productos reaccionen (ten en cuenta que no es más que una proporción). Por ello, en ningún caso la modificación del volumen hace que cambiemos la reacción. La reacción la ajustamos al principio del ejercicio y no la cambiamos más, a no ser que en otro apartado nos den la reacción ajustada de forma distinta. Pero no es el caso.
En cuento a que Qc = 1/4Kc ten en cuenta que Qc es con las concentraciones iniciales, mientras que Kc es con las concentraciones una vez alcanzado el equilibrio.
Te sugiero que veas los vídeos teóricos anteriores sobre esto para aclararte más dudas:
http://www.quimitube.com/videos/constante-de-equilibrio-kc-ley-de-accion-de-masas
http://www.quimitube.com/videos/cociente-de-reaccion-qc
Asimismo aquí tienes todos los vídeos de teoría de equilibrio en orden, te servirán:
http://www.quimitube.com/teoria-equilibrio-quimico
QuimiTube, 9 Años Antes
tengo otra pregunta, cuando desarrollas Qc en el video dices que :
Qc= 4/16 * (NH3)/ (N2)*(H2) Y y a los reactivos le llamas Kc mientas en el enunciado escrito sigues manteniendo los coeficientes estequiometricos. 4/16 * (NH3)2 / (N2) (H2)3
enrique, 10 Años Antes
Hola buenas
ayer escribí un comentario pero no quedó guardado.
Mi pregunata es la siguiente: en el video cuando desarrollas la ecuancion de Qc al finalizar igualas Qc = 4/16 x (NH3)/ (N2)* (H2)
Ssin mantener sus coeficientes estequiometricos mientra en el enunciado aparece Qc = 4/16 x (NH3)2/ (N2)* (H2)3
.¿cual de las dos esta bien?
enrique, 9 Años Antes
Hola de nuevo, ahora entiendo mejor tu pregunta. Tienes razón, en el vídeo me he dejado los coeficientes estequiométricos, pero hay que mantenerlos. Por tanto estaría bien la segunda. Un saludo.
QuimiTube, 9 Años Antes
Muchas gracias, explicas muy bien.
Me estais ayundando a recordar muchas cosas que e olvidado con el tiempo.
un saludo.
Enrique, 9 Años Antes
Como harías este ejercicio, es que no se como plantearlo. La constante de equilibrio para la reacción CO + H2O genera H2 + CO2 tiene un valor de 5,1 a 527 Celsius. Calcule la presión de equilibrio de cada una de las especies, si se carga un recipiente con 1 atm de monóxido de carbono y 3 atm de agua, y se le permite llegar al equilibrio.
Muchas gracias.
marcos, 9 Años Antes
Hola Marcos, para empezar daría por hecho que la constante de equilibrio que te dan es Kp, es decir, en función de las presiones parciales. Al darte las presiones parciales iniciales de los reactivos, sabes que tienes una presión total de 4 atmósferas (1 de CO + 3 de H2O). Como lo que se genera tiene la misma relación de coeficientes estequiométricos (por cada 2 moles que reaccionan de reactivos se producen 2 moles de productos, 1 mol de H2 y 1 mol de CO2) esto implica que en el equilibrio también tendrás una presión total de 4 atmósferas. Con esto y seguramente también con la fórmula de los gases ideales, que te permitirá conocer el número de moles, ya podrías resolver el ejercicio. Un saludo.
QuimiTube, 9 Años Antes
Hola profesora, realmente explica muy bien, felicidades por esa gran virtud, ayuda a muuuuuchas personas 😀 Quería preguntarle si la modificación de presión y volumen afecta únicamente el equilibrio para reacciones de gases, o si también se produce en reacciones con sólidos o líquidos. Muchas gracias de antemano!!
johana, 9 Años Antes
Hola Johana, esencialmente afecta a los gases. Un saludo grande y gracias por tu comentario.
QuimiTube, 9 Años Antes