Contenido del Vídeo
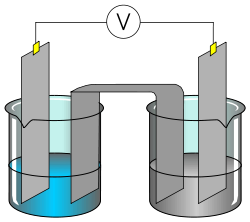
Explicaremos con detenimiento cómo formar una pila para aprovechar la energía de la reacción redox del zinc metálico con el ión cobre (II) en forma de energía eléctrica. Para que esto pueda suceder, es necesario separar físicamente las dos semirreacciones: la semirreacción de oxidación, la del zinc, se llevará a cabo en un recipiente, mientras que la semirreacción de reducción, la del cobre (II), se llevará a cabo en otro recipiente distinto. En cada una de las disoluciones (una disolución de sulfato de zinc y otra disolución de sulfato de cobre) introduciremos un electrodo de zinc (ánodo) y uno de cobre (cátodo) respectivamente, que estarán unidos mediante un conductor externo (un cable) y un puente salino. El dispositivo formado de este modo recibe el nombre de pila Daniell, y tiene un potencial estándar o fuerza electromotriz de 1,1V a 25ºC.
Category: Teoría Oxidación Reducción y Vídeos Redox.
Etiquetas: Pilas galvánicas: teoría y ejercicios.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Excelente video, me sirvio demasiado, me gustaría saber si tienes algún correo para realizar algunas preguntas sobre el tema, ya que, estoy estudiando Metalurgia y me encuentro en la asignatura de Electrometalurgia. Gracias.
Atte.
Joel Tapia Fabian.
Joel Tapia, 13 Años Antes
Hola Joel, bienvenido. Me alegro mucho de que te sirviera el vídeo y gracias a ti por comentar.
En cuanto al correo, además de comentar por aquí puedes escribir en el muro de facebook, mensaje privado en facebook (aunque es el que menos recomiendo porque cuesta más gestionar los mensajes nuevos y los que se han respondido o no) y el e-mail quimitube@gmail.com.
Un saludo,
Carmen
QuimiTube, 13 Años Antes
Buenas tardes, solo me gustaría decirte que por favor, si intentas explicar algo y ya que le das millones de vueltas a las cosas, cosa que veo normal, por lo menos podrías decir de donde sacas los datos. Acabas de decir que la pila daniell tiene una fem de 1.1 w, por qué? te lo sacas de la manga? explica las cosas!!!!
hjgj, 11 Años Antes
¡Hola! Los valores de potenciales redox se calculan en el laboratorio y se tabulan (http://www.quimitube.com/wp-content/uploads/2012/04/Tabla-de-potenciales-estandar-reduccion.pdf), y así está determinado para la pila Daniell, experimentalmente (míralo por ejemplo aquí http://www.quimitube.com/fabricacion-de-una-pila-daniell-con-un-limon). Si sigues viendo el resto de los vídeos podrás ver cómo calcular el potencial de una pila a partir de los potenciales estándar de reducción; en este vídeo no lo indicamos porque todavía no hemos explicado eso y siempre seguimos un orden; no puedo decir cómo lo calculo si aún no he explicado qué es la fem de una pila exactamente, o este es mi enfoque. Obviamente cada cual lo ve de un modo distinto y siento si crees que a veces doy demasiadas vueltas. Para calcularlo, lo que debes hacer es Eo = E cátodo – E ánodo, como aquí se explica:
http://www.quimitube.com/videos/pilas-fuerza-electromotriz
Y aquí tienes un ejemplo de cálculo:
http://www.quimitube.com/videos/calculo-fueza-electromotriz-pila-galvanica-cadmio-plata
Te sugiero que veas todos los vídeos para no pensar que nos sacamos los datos de la manga, lo que suele ocurrir es que está en otro apartado en el que profundizamos más, como sucede en un libro. Es mejor tener una visión de conjunto.
Un saludo.
QuimiTube, 11 Años Antes
simplemente perfecto!!… es increible.. me esta siviendo de mucha ayuda para estuar y prepararme para el selectivo y ademas y me ayudara mucho porque me perdere una clases estos dias y la verdad esque esta todo muy bien explicado!! 🙂
Youcef Bourahel, 13 Años Antes
Muchísimas gracias y bienvenido 🙂 Me alegro mucho de que te estén sirviendo de ayuda, espero que te vaya muy bien selectividad porque no es un examen fácil. Gracias por comentar, un saludo grande 🙂
QuimiTube, 13 Años Antes
y tengo una duda… si teneis alguna axplicacion de la electrolisis me serviria de mcha ayuda la verdad.. :).. si puede ser dejame el link por aki o en mi correo
Youcef Bourahel, 13 Años Antes
No tenemos explicación teórica de la electrolisis todavía, pero sí algunos ejercicios resueltos que también te vendrán muy bien, están aquí:
http://www.quimitube.com/videostags/electrolisis/
QuimiTube, 13 Años Antes
Hola! Me encanta la página, me sirve mucho para mis estudios en la universidad.. La verdad que está todo muy bien explicado y muy claro. Me gustaría saber qué sucede si agrego NH3 concentrado a la solución donde se encuentra el cobre.. Por qué motivo es que disminuye el potencial? Muchas gracias!
Leonardo, 12 Años Antes
¡Hola Leonardo! El amoníaco puede complejar al cobre (II), por lo que aparentemente disminuiría la concentración de cobre en solución y te podría cambiar el potencial de la pila. Un saludo y muchas gracias por tu comentario.
QuimiTube, 12 Años Antes
La verdad es que me encantan tus videos, tu forma de explicar y de transmitir los conocimientos. Gracias, eres buenísima profesora. Ojalá hubiera más gente como tú.
Marta, 12 Años Antes
Hola Marta, bienvenida. ¡Muchísimas gracias! Vuestros comentarios dan mucho ánimo, intento mejorar cada día para que los vídeos sean lo mejor posible, poco a poco… Gracias de nuevo y un saludo muy grande.
QuimiTube, 12 Años Antes
Hola! Antes que nada quisiera felicitarte por tus videos y explicaciones! Eres una excelente profesora. Soy estudiante de Ingeniería Química y tus videos me sirven muchísimo! Hoy rendí un examen y uno de los ejercicios era de pilas, y no lo entiendo muy bien, ojala me puedas dar una mano… Dice así: el potencial del Cu frente al Cu+2 es -0,34 V y frente al Cu+1 es -0,52 V. Calcular la constante te equilibrio correspondiente a la reacción: Cu + Cu+2 –> 2 Cu+1 … La verdad me costó trabajarlo, sí apliqué la ecuación de Nernst pero creo que calculé mal el potencial estándar de la pila correspondiente a esa reacción.
Desde ya muchas gracias! Saludos desde Argentina!
Roxana, 12 Años Antes
Hola Roxana, bienvenida. Me alegra que te sirvan los vídeos aunque tus contenidos son mucho más complejos que los ejercicios que aquí planteamos. ¿Cómo has planteado las semirreacciones de la pila? ¿Qué semirreacción has considerado en el cátodo y cuál en el ánodo? Un saludo grande.
QuimiTube, 12 Años Antes
Gracias por tu respuesta! Para calcular la fem estándar de la pila considere como cátodo al de potencial menos negativo, es decir el potencial -0,34 que corresponde a la reacción
Cu –> Cu+2 + 2e- como una reducción implica una ganancia de electrones, estos deberían estar en los reactivos entonces invertí el orden de la reacción Cu+2 + 2e- –> Cu, entonces el signo del potencial se invierte.
Por descarte considere como ánodo a la otra reacción
Cu –> Cu+1 + 1e-
Para armar la pila sumé ambas reacciones, multiplicando por dos la segunda para igualar el número de electrones… Según lo que tengo entendido, multiplicar por un coeficiente una reacción no modifica la fem estándar de la pila, verdad? De esta forma obtengo la siguiente ecuación de la pila
Cu + Cu+2 –>2Cu+1 que es la del enunciado del problema. Para calcular la fem estándar resto el potencial del cátodo menos el del ánodo (lo que no me queda claro aquí es si ambos potenciales deben ser de reducción o ambos de oxidación? O son los potenciales de las reacciones… Se me presenta un problema con los signos). Con ese resultado, apliqué la ecuación de Nernst, donde E=0 por estar en el equilibrio. De allí despeje la constante de equilibrio K.
Creéis que lo resolvi bien?
Te agradezco muchísimo. Saludos!
Roxana, 12 Años Antes
Hola Carmen! Excelente video, muy comprensible. Gracias!
claudia, 12 Años Antes
Gracias Claudia 🙂
QuimiTube, 12 Años Antes
Muy buena la explicación. Gracias
Sara, 12 Años Antes
De nada Sara, bienvenida.
QuimiTube, 12 Años Antes
Muchas gracias por la explicacion la mejor enseñando creo yo…..sabes explicar como es. inteligente, bonita y pare de contar muy bien hecho.!
george, 12 Años Antes
Muchas gracias por tu comentario, George. Un saludo grande.
QuimiTube, 12 Años Antes
Hola, en primer lugar gracias por todo, mi clase está aprobando química en gran parte por tus videos jeje me pregunto si hay en tu web información sobre concentraciones dadas en normalidad, pues tengo algunas dudas. Gracias de antemano
Roberto, 12 Años Antes
Hola Roberto, muchas gracias por tu comentario, me alegra que os sirva 🙂
En cuanto al tema de la normalidad no tenemos nada, ya que aún no he grabado vídeos de estequiometría. Sin embargo, si tienes algunas dudas concretas me las puedes formular.
Un saludo,
Carmen
QuimiTube, 12 Años Antes
¡Hola! Antes de nada, agradecerte toda la explicación tan detallada del temario de química que entra en selectividad 🙂 De verdad que muchísimas gracias.
Pero tengo unas dudillas sobre la pila Daniell a ver si logras hacérmelo ver ya que mi profesora de química se sacó el título de graduada en química en la tómbola y no sabe ni lo que dice… En la pila Daniell, en ambos recipientes donde hay las disoluciones de Zinc y Cobre, ¿Somos nosotros quien, previamente, preparamos una disolución de Cu+2 por ejemplo? ¿O estos iones los va desprendiendo poco a poco el electrodo?
En el caso de que sea el electrodo quien va desprendiendo los iones, ¿Qué ocurriría con un electrodo inerte como el grafito?
En el caso de que seamos nosotros quien previamente preparamos la disolución, por ejemplo, sulfato de cobre como dices. ¿Por qué hay que poner un electrodo, en este caso, de cobre? ¿No podría ser un electrodo inerte como el grafito?
Mientras transcurre la reacción redox, obviamente se van «gastando» los iones y como bien dices provoca que en uno de de los recipientes de los electrodos se produzca una polaridad negativa y en el otro una polaridad positiva. ¿Qué efecto tiene el puente salino en todo esto? A ver, yo entiendo que es para contrarrestar la polaridad positiva y la polaridad negativa pero no entiendo el porque hay que contrarrestar este efecto, ¿Qué ocurriría a nivel molecular si no pusiéramos el puente salino?
La reacción, por ejemplo la oxidación, en el ánodo tenemos zinc metálico. ¿Dónde se produce el desprendimiento de electrones? Yo tengo dos posibles respuestas:
1) En la misma disolución se van desprendiendo electrones que son conducidos hacia el ánodo.
-En este caso: ¿Qué es lo que empuja a los electrones hacia el ánodo? Yo entendería que los electrones se quedarían en la misma disolución.
2) El desprendimiento de electrones se da directamente en el ánodo y los iones resultantes de Zn+2 se quedan en la disolución, que es por ello por lo que adquiere la polaridad positiva.
-En este caso: Inicialmente, deberíamos tener una disolución de zinc metálico que luego se transforma en Zn+2, pero esto no me termina de cuadrar si somos nosotros quien previamente preparamos una disolución de Zinc porque zinc metálico no se podría disolver. Yo pienso que en realidad, la disolución de Zn+2 se da después de la oxidación. ¿Entonces qué tenemos inicialmente?
Muchísimas gracias!!
El problema es que yo soy una persona que necesito entender todo a la perfección y estas preguntas se las hago a mi profesora de química y me dice que no estoy atento y eso es mentira. Entonces me he visto tu vídeo y he terminado de entender muchísimas cosas por eso te vuelvo a dar las gracias! Las únicas dudas que me han quedado han sido esas 🙂
Cristian, 12 Años Antes
FE DE ERRORES:
-Línea 9: Cuando digo: «A ver, yo entiendo que es para contrarrestar la polaridad positiva y la polaridad negativa pero no entiendo el porque hay que contrarrestar este efecto» Al decir polaridad positiva no lo he expresado bien ya que no tiene nada que ver, me refería a que la disolución adquiere una carga positiva, lo mismo con lo de polaridad negativa.
SORRY 🙁
Cristian, 12 Años Antes
¡Hola Cristian! Guau, vaya comentario 🙂 A ver si puedo responder a tus preguntas de forma satisfactoria, aunque algunas respuestas te parecerá un poco vagas porque aquí es difícil profundizar más (sin esquemas ni dibujitos…).
– Nosotros preparamos una disolución de cada uno de los metales (te recomiendo leer esta entrada, creo que te gustará: http://www.quimitube.com/fabricacion-de-una-pila-daniell-con-un-limon/). No obstante, como tu indicas, podrías usar un electrodo de grafito en lugar de uno de cobre, porque el cobre, como se está reduciendo (pasa de la disolución, Cu2+, a cobre metálico) se depositaría sobre el electrodo de grafito; el de zinc no podrías cambiarlo, porque se está oxidando y hay un paso real de zinc del electrodo a la disolución, es decir, de Zn(0) a Zn2+. Sin embargo, poner un electrodo de grafito en lugar de uno de cobre te podría cambiar el potencial de la pila, y simplemente es que la pila Daniel por definición es así, con el electrodo de cobre y el de zinc (cambiando por grafito sería una pila, pero no Daniel).
– Si no ponemos puente salino se crea una diferencia de potencial entre los electrodos que impide una nueva transferencia de electrones. El puente salino «elimina» esta diferencia de potencial, posibilitando que se dé un nuevo intercambio electrónico y que la reacción transcurra, sucesivamente. Si no lo pusieras, por esta diferencia de potencial, el proceso dejaría de ser espontáneo.
– El desprendimiento e intercambio de electrones, ya sea en el ánodo o en el cátodo, se da siempre en la superficie del electrodo, nunca en la disolución.
– La disolución de Zn2+, efectivamente, no tendría por qué prepararse inicialmente, ya se va formando a medida que la oxidación transcurre y pasa de Zn metálico a Zn2+. Sin embargo se prepara una disolución 1M porque con disoluciones 1M tenemos una pila Daniel estándar, con un potencial de 1 voltio. A medida que se produce Zn2+ esta concentración irá cambiando porque se está formando más. De hecho podrías calcular cuántos moles de Zn2+ se han formado cuando transcurre una determinada cantidad de corriente, cómo varía la concentración total de Zn y cómo varía, por tanto, el potencial de la pila (que habrá dejado de ser estándar porque y a no es 1M); pero esto último se haría con la ecuación de Nernst, que es de nivel universitario.
Espero haber resuelto tus dudas o la mayoría de ellas. Me gusta mucho que un alumno profundice tanto en un tema y se plantee tantas cosas 🙂
Un abrazo.
QuimiTube, 11 Años Antes
Muchísimas gracias!!!!!!! He ido pensando cuando leía tus respuestas y ahora me encajan mis dudillas sobre pilas y ahora ya le encuentro sentido:) De verdad que muchísimas gracias!! Llego a conocer antes quimitube y te aseguro que sacaría todo 10.
Seguramente me verás preguntándote más cosas así en los temas de estructura de la materia y de enlace ya que en breve terminaremos redox y empezaremos a estudiar esos temas y seguramente tenga 1000 dudas xD
Te lo vuelvo a decir, muchísimas gracias!
Cristian, 11 Años Antes
Hola,quisiera saber si me puedes ayudar tengo que hacer para mi clase de electróquimica un experimento que lleve electróquimica todo en relación a redox,balanceo básico etc podría ser que me brinden alguna idea. Cualquier comentario te dejó mi correo os_car_21@hotmail.com
Oscar, 11 Años Antes
Hola Óscar, aquí tienes algunas prácticas de electroquímica que te pueden servir:
http://www.quimitube.com/fabricacion-de-hipoclorito-sodico-lejia-casera-con-una-pila-y-agua-con-sal/
http://www.quimitube.com/fabricacion-de-una-pila-daniell-con-un-limon/
QuimiTube, 11 Años Antes
Primero de todo agradecer el tiempo y dedicación que inviertes en esta web. Y después me gustaría saber si me puedes resolver la siguiente duda. En la pila Daniell el Zn actúa como reductor y el Cu como oxidante.Lo que no entiendo es porque no es el cobre el que actúa como reductor, al aumentar el carácter reductor inversamente a la electronegatividad, y según están dispuestos en la tabla periódica, el Cu sería el reductor. Gracias y espero que me pueda resolver esta duda.
Andrea, 11 Años Antes
Hola Andrea, es una muy buena pregunta. Realmente cabría esperar que el zinc fuese más electronegativo al hallarse más a la derecha de la tabla periódica y que, por tanto, fuese el cobre el reductor. Sin embargo, si miras lo valores de electronegatividad, verás que la del cobre es 1,9 y la del zinc 1,65, es decir, hay una inversión de la tendencia en este punto, como ocurre en muchos casos en los metales de transición. Imagino que si es así, y el zinc se comporta como reductor, es porque el catión Zn(2+) será un catión bastante estable y le «cuesta» menos trabajo al zinc ceder esos dos electrones. Espero haberte ayudado. Un saludo.
QuimiTube, 11 Años Antes
Gracias por resolverme la duda. Saco la conclusión entonces de que la posición en la tabla periódica está ligada a la electronegatividad como norma general, aunque hay algunas excepciones. Gracias de nuevo.La verdad es que es admirable la labor que
llevas a cabo en esta página, esto de la química te tiene que gustar bastante, de otra manera no sería posible.
Andrea, 11 Años Antes
Exacto, la conclusión a la que llegas es correcta.
Me gusta mucho la química y también la enseñanza, todo lo que se relacione con la educación y con el aprendizaje me apasiona.
Un saludo grande.
Quimitube, 11 Años Antes
Hola!! Muchísimas gracias por las explicaciones! Explicas muy bien y me sirve muchísimo para lograr «traducir» lo que explica el profe en clase…En serio muchas gracias… pero tengo una dudita: ¿por que razón se preparan disoluciones a ambos lados? ¿Sólo para generar iones sulfato (por ejemplo) y cationes Cu+2 y Zn+2? ¿REDOX no ocurriría lo mismo?
Gracias!
Rosario, 11 Años Antes
¡Hola! Realmente solo necesitas los iones Cu2+, ya que son estos los que actúan como oxidantes, captando electrones y pasando a Cu. Los iones Zn2+ no serían imprescindible, pero tener una concentración 1M de estos hace que la pila tenga un potencial estándar. Sin embargo, el zinc se está oxidando, pasando de Zn(0) (el zinc metálico del electrodo) a la disolución, pero no se da la reacción inversa. De todos modos además de por el potencial estándar es habitual tener ese mismo ión en disolución, especialmente para evitar tener otro ion que pueda interferir. Un saludo.
QuimiTube, 11 Años Antes
¡Hola!Muy buen video, con unas explicaciones excelentes. Tengo una duda, tengo que crear una pila, y a la hora de elegir las reacciones de oxidación y reducción, ¿el Zn y el Cu son las mas factibles? Es decir, ¿si utilizo otro tipo de material, podré crear una pila? Es que la pila Danniel, es la más escuchada, y no se, si es por su eficacia o por otra razón. Muchisimas gracias.
Maider, 10 Años Antes
¡Hola! La pila Daniell es la más escuchada porque fue de las primeras pilas en desarrollarse y, como además sus reacciones son sencillas, resulta fácil explicar su funcionamiento como base para entender otras pilas. Yo creo que por esto es la «más famosa». Además, también se une a ello que el zinc y el cobre son materiales relativamente sencillos de conseguir y baratos, por esto también es que te pueden resultar muy útiles. Te recomiendo mirar la tabla de potenciales para ver qué semirreacciones te podrían servir:
http://www.quimitube.com/wp-content/uploads/2012/04/Tabla-de-potenciales-estandar-reduccion.pdf
Y también mirar el resto de vídeos sobre pilas:
http://www.quimitube.com/videostags/pilas-galvanicas
En especial creo que este puede serte muy útil para elegir qué materiales utilizar en sus semirreacciones:
http://www.quimitube.com/videos/pilas-galvanicas-electrodo-inerte
Si eliges un reactivo que sea una sal disuelta (como el permanganato) tendrás que usar un electrodo de grafito.
En este entrada de blog no tenemos una pila sino una electrolisis pero verás cómo puedes usar una electrodo de grafito:
http://www.quimitube.com/fabricacion-de-hipoclorito-sodico-lejia-casera-con-una-pila-y-agua-con-sal
Un saludo
QuimiTube, 10 Años Antes
Hola, ¿el puente salino no debería estar sumergido en las soluciones?
Guillermo, 10 Años Antes
Hola, que buen video, me encanta lo que haces y la manera de explicar! tengo una duda, que pasaria si a la chapita de zinc la sumergimos en una solucion acuosa de CuSO4 y al cobre en una de ZnSO4? gracias
Victoria Lopez, 5 Años Antes
¡Hola Victoria! ¡Gracias! Si miras en la tabla de potenciales redox https://www.quimitube.com/wp-content/uploads/2012/04/Tabla-de-potenciales-estandar-reduccion.pdf verás que el Cu2+ tiene cierto poder oxidante frente al Zinc metálico, dado que está más arriba en la tabla. Esto implica que cuando sumerjas una plaquita de zinc en CuSO4, cierta cantidad de cobre metálico se deposite en la superficie de la placa de zinc (tomará color cobre en la superficie) y que una cantidad equivalente de zinc pase a catión Zn2+, quedando en disolución. En cambio si sumerges una placa de cobre metálico en ZnSO4, esto no sucederá porque el zinc(II) no tiene capacidad de oxidar al cobre metálico.
QuimiTube, 5 Años Antes
Hola que tal? muy buen video, tengo una pregunta, porque cuando mido experimentalmente la diferencia de potencial tiene un valor de 1,06V y no 1,1V a que se puede deber? como podria justificarlo? es para un informe, gracias
poli, 5 Años Antes
¡Hola! Se podría deber a que no tengas condiciones estándar, por ejemplo, que no estés a 25ºC de temperatura o también que la concentración de las disoluciones no sea 1M.
QuimiTube, 5 Años Antes