Contenido del Vídeo
Como hemos visto en el apartado 2 de teoría de equilibrio químico, relativo a la constante de equilibrio Kc, el valor de esta constante depende de la temperatura. Por tanto, cuando en un sistema en equilibrio se modifica la temperatura, deja de estar en equilibrio porque se modifica el valor de la constante de equilibrio. Así, a una temperatura T1 la constante vale K1, y a una temperatura T2, la constante vale K2. La relación entre estas magnitudes viene dada en la denominada ecuación de Van’t Hoff:
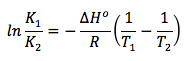
Donde:
ΔHo: entalpía estándar de la reacción
R: constante de los gases ideales
K1: constante de equilibrio a la temperatura T1
K2: constante de equilibrio a la temperatura T2
La ecuación de Van’t Hoff nos permite estudiar de forma cualitativa cómo se desplaza el equilibrio químico con la temperatura en función de que tengamos una reacción endotérmica o exotérmica:
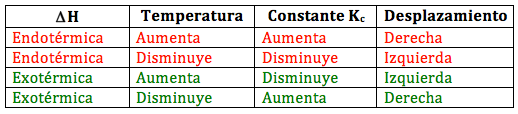
- Si una reacción es endotérmica, ΔH > 0, al aumentar la temperatura aumenta la constante de equilibrio y el equilibrio se desplaza hacia la derecha (hacia la formación de productos, aumentando el numerador). En cambio, si la temperatura baja, también baja la constante de equilibrio y la reacción se desplaza hacia la izquierda.
- Si una reacción es exotérmica, ΔH < 0, al aumentar la temperatura disminuye la constante de equilibrio y la reacción se desplaza hacia la izquierda, mientras que si la temperatura disminuye, aumenta la constante de equilibrio y el equilibrio se desplaza hacia la derecha.
En resumen:
Otra forma sencilla de expresar esto de forma simplificada es que un aumento de la temperatura favorece el sentido en el que la reacción es endotérmica, y una disminución el sentido exotérmico. Así, si tenemos el siguiente proceso:
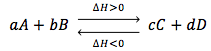
- Al aumentar la temperatura se favorece ΔH > 0, por tanto hacia la derecha.
- Al disminuir la temperatura se favorece ΔH < 0, por tanto hacia la izquierda.
También te puede interesar:
Equilibrio químico 7.1. Principio de Le Châtelier: modificación de la concentración
Equilibrio químico 7.2. Principio de Le Châtelier: modificación de la presión y del volumen
Category: Equilibrio Químico, Teoría de Equilibrio Químico y Vídeos Equilibrio Químico.
Etiquetas: Principio de Le Châtelier.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Porque la formua es ln K1/K2? no es ln k2/k1?
javier, 10 Años Antes
Hola Javier, la deducción matemática sería posible de las dos formas, solo es una relación. Un saludo.
QuimiTube, 10 Años Antes
Hola, gracias por los videos. Estos últimos de equilibrio químico no están en la lista de reproducción de youtube. Si los pusieras ahí seguro que los vería más gente.
Saludos.
Guillermo, 10 Años Antes