Contenido del Vídeo
Concepto de entalpía de reacción estándar: condiciones termoquímicas estándar
Vamos a profundizar en este apartado en un concepto fundamental en termoquímica, el concepto de entalpía de reacción, ΔHr. Definimos la entalpía de una reacción química como el calor absorbido o desprendido en dicha reacción química cuando ésta transcurre a presión constante, es decir:
ΔH = QP
ΔH : entalpía de la reacción
QP : calor transferido a presión constante
El valor de entalpía es distinto según a qué presión y a qué temperatura se lleve a cabo la reacción. Por este motivo se definen unas condiciones estándar. Las condiciones estándar termoquímicas son 25ºC (o 298 K) y 1atm de presión (1,013·10^5 Pa). Cuando la reacción se lleva a cabo en dichas condiciones estándar, su variación de entalpía (ΔH) recibe el nombre de entalpía estándar de reacción o también entalpía normal de reacción, y se representa como ΔHor.
Las unidades de la entalpía estándar de reacción son kJ o kJ/mol, siendo esta última la forma más habitual de hallar los valores de entalpías en las distintas tablas.
Ecuaciones termoquímicas
La forma más habitual de indicar la entalpía estándar de una reacción química es en las llamadas ecuaciones termoquímicas, que consisten en escribir la reacción, correctamente ajustada y con los estados de agregación de todos los compuestos que intervienen, y añadir, a la derecha, el valor de la entalpía estándar. Por ejemplo, a continuación vemos la ecuación termoquímica para la reacción de combustión del etanol y para la reacción de combustión del monóxido de carbono:
El motivo de que en la ecuación termoquímica se deban indicar los estados de agregación de productos y reactivos, es decir, si son gases, líquidos o sólidos, y también la forma alotrópica (por ejemplo, carbono grafito o carbono diamante), es porque de ello también depende el valor de la entalpía de la reacción.
Además, puesto que la entalpía es una variable extensiva, es decir, depende de la cantidad total de materia, si la ecuación termoquímica se ajusta de un modo distinto, cambiará su valor, siempre y cuando el valor venga dado en kJ (y no en kJ/mol). Por ejemplo:
![]()
Esta ecuación termoquímica nos indica que cuando 2 moles de monóxido de carbono reaccionan con un mol de O2, se desprenden 566 kJ de calor, mientras que, tal y como hemos visto previamente en la misma reacción pero ajustada para 1 mol, se desprenden la mitad, 283 kJ de energía calorífica.
Reacciones endotérmicas y reacciones exotérmicas
En las ecuaciones termoquímicas indicadas previamente aparecen los correspondientes valores de entalpía estándar de reacción para diversas reacciones, y todas ellas tienen signo negativo. ¿Qué significa el signo de la entalpía? Según el criterio establecido por la IUPAC, que hemos explicado al hablar de la transferencia de energía en forma de calor, es negativo el calor desprendido por el sistema, y positivo el calor absorbido por el sistema. Así, si la entalpía de reacción es negativa, significa que durante el transcurso de la reacción, el sistema pierde o libera calor hacia el entorno, mientras que si la entalpía de reacción es positiva significa que durante el transcurso de la reacción, el sistema absorbe calor del entorno. En función del signo de la entalpía, las reacciones se clasifican como endotérmicas y exotérmicas:
- Una reacción exotérmica es aquella cuyo valor de entalpía es negativo, es decir, el sistema desprende o libera calor al entorno (ΔH < 0).
- Una reacción endotérmica es aquella cuyo valor de entalpía es positivo, es decir, el sistema absorbe calor del entorno (ΔH > 0).
Por ejemplo, la reacción que hemos considerado previamente, de oxidación del monóxido de carbono para dar dióxido de carbono, tiene variación de entalpía negativa:
Esto significa que se desprende calor en el transcurso de la misma y es, por tanto, una reacción exotérmica, mientras que si consideramos la misma reacción pero en sentido contrario, el valor absoluto de la entalpía se mantiene, pero el signo cambia, siendo en este caso la entalpía positiva y, por tanto, una reacción endotérmica:
Distintos tipos de entalpías de reacción: entalpías de combustión y entalpías de formación.
Aunque cualquier entalpía es, por definición, una entalpía de reacción (variación de calor a presión constante asociada a una reacción química) es frecuente especificar un poco más y, en lugar de llamarla entalpía de reacción, indicamos el tipo de reacción a que se refiere, por ejemplo, en el caso del CO y el oxígeno, se trata de una reacción de combustión, por lo que a su entalpía de reacción se la puede llamar entalpía de combustión, ΔHoc
Del mismo modo sucede, por ejemplo, con las entalpías de las reacciones de formación de un compuesto, que reciben el nombre de entalpías de formación, y que veremos con detenimiento en el apartado próximo por su gran utilidad y la frecuencia de su uso.
Diagramas entálpicos
Un diagrama de entalpía es un gráfico que permite mostrar de un modo visual la variación de entalpía de una reacción química. Si nosotros tenemos una reacción:
R –> P ΔHoR
![]()
Como el valor absoluto de entalpía no se conoce, el origen de la escala de entalpías es arbitrario. Por ello, lo que se hace es representar reactivos y productos, siendo la diferencia entre ellos el valor de entalpía de la reacción.
Si la reacción es endotérmica, es decir, absorbe calor, el diagrama de entalpía tendrá la forma siguiente:
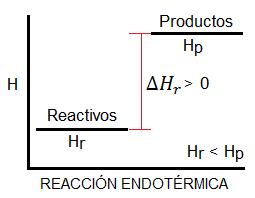
Si la reacción es exotérmica, es decir, desprende calor, el diagrama de entalpía tendrá la forma siguiente:
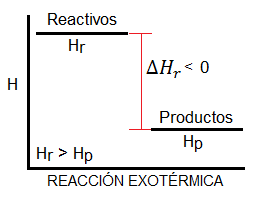
A continuación te mostramos otros vídeos que también te pueden interesar para preparar el tema de variación de entalpía o los conceptos aquí tratados, tanto teoría como ejercicios:
Teoría
Termodinámica Teoría 7: Transferencia de calor a presión constante. Concepto de entalpía (H)
Termodinámica Teoría 10: Definición de entalpía de formación y ejemplos
Termodinámica Teoría 11: Cálculo de la entalpía de reacción a partir de las entalpías de formación
Termodinámica Teoría 14: Cálculo de la entalpía de reacción mediante la Ley de Hess
Ejercicios
Termodinámica Ejercicio 10: Ecuaciones termoquímicas y cálculo de la entalpía de algunos procesos
Termodinámica Ejercicio 11: Ecuación termoquímica de combustión del butano y energía de una bombona
Asimismo, a continuación tienes todos los vídeos de teoría y de ejercicios del tema:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola!!! buenisimos videos, gracias!!!! Oye el enlance para el video de termodinámica teoría 7 no funciona.
Espero lo puedan soucionar. Saludos!! 🙂
toño, 12 Años Antes
¡Hola! Gracias por el comentario y por el aviso, ya está arreglado 😀 Era un despiste de los míos jeje. Un saludo grande.
QuimiTube, 12 Años Antes
Que buen día hace hoy en alicante = ) y con estos pedazo vídeos de termoquímica… que más se puede pedir. jajaj
Por cierto active los subtitulos por casualidad y que risa…
Un saludo, gracias por todo el esfuerzo dedicado ^ ^
Pedromagna, 12 Años Antes
¡¡Sí!! Yo incluso hice una vez capturas de pantalla para enseñar a la gente de lo mucho que me reía… Dice cada barbaridad… Es buenísimo.
QuimiTube, 12 Años Antes
Gracias por compartir esos conocimientos y enseñarlos de manera clara y concreta.
Jose, 12 Años Antes
Gracias a ti por comentar, Jose, y bienvenido.
QuimiTube, 12 Años Antes
Hola no entendia la parte de ecuaciones termoquimicas como se obtiene la variacion de entalpia de reaccion de «CH3CH3OH+302——2CO2+3H20, yo tengo una tablan con la que calcule la segunda ecuacion de ejemplo pero la primera no aparece, ademas no me quedo claro el concepto de KJ/mol no entiendo el porque es igual, si pudiera explicarme se lo agradeceria, todo lo demas muy bueno estoy viendo todos los videos de termodinámica saludos.
Matias, 11 Años Antes
Hola Matías, te sugiero que veas el siguiente ejercicio resuelto, te ayudará:
http://www.quimitube.com/videos/termodinamica-ejercicio-18-calculo-de-la-entalpia-de-combustion-del-etanol-con-entalpias-de-formacion
En ese ejercicio resuelto calculamos la entalpía de combustión del etanol con las entalpías de formación.
QuimiTube, 11 Años Antes
Muy bueno el video, pero me quedo una duda, nose como sacar la cantidad de kj en la ecuacion termoquimica, osea nose como sacar los valores.. nose si se entiende a que me refiero. Un saludo grande y gracias por compartir el video..
cristian aguirre, 10 Años Antes
Hola Cristian, tienes formas distintas aunque eso lo tenemos en vídeos posteriores. Te sugiero que los mires:
http://www.quimitube.com/videos/termodinamica-teoria-10-definicion-de-entalpia-de-formacion-y-ejemplos
Bueno, en general aquí tienes los distintos vídeos teóricos:
http://www.quimitube.com/teoria-de-termodinamica-quimica
QuimiTube, 10 Años Antes
Hola hay algo que ando buscando y no incuentro nada, nesecito saber la solubilidad, punto de ebillicion y punto de fusión de las sustancia ionicas, covalentes y metalicas
valeria, 10 Años Antes
Te sugiero ver estos vídeos:
Propiedades de las sustancias iónicas: http://www.quimitube.com/videos/propiedades-de-los-compuestos-ionicos
Propiedades sustancias covalentes: http://www.quimitube.com/videos/propiedades-de-las-sustancias-covalentes-moleculares
Y metálicas: http://www.quimitube.com/videos/propiedades-de-los-compuestos-metalicos
QuimiTube, 10 Años Antes
gracias, por compartir y hacer claros estos ejercicios, soy profesor en un instituto y para que los alumnos puedan reforzar y tener mejor entendimiento de la materia, van clase a clase siguiendo tu ayuda.
víctor varas, 10 Años Antes
Muchísimas gracias Víctor, es un honor que siendo profesor compartas con tus alumnos este material, te lo agradezco mucho. Un saludo grande.
QuimiTube, 10 Años Antes
me puedes dar clses para mi examen porfa
eliane, 10 Años Antes
Hola Eliane, lo siento mucho, no tengo tiempo material ahora mismo para dar clases particulares vía Skype.
QuimiTube, 10 Años Antes
Excelentes videos y muy explicativos.
Quiero calcular el calor de reacción del Peróxido de Di-Isononanoilo, C18H34O4 (formula condensada). Lo quise obtener con la Ley de Hess, pero no encontre datos bibliograficos de entalpia de combustion del citado compuesto…algúna método para cálcularlo en forma teórica. Gracias !
Jorge V, 10 Años Antes
¡Hola! ¿La reacción es a partir de qué? Si tienes la reacción completa puedes calcular la entalpía de la reacción a partir de las entalpías de formación de los compuestos que intervengan como hacemos aquí:
http://www.quimitube.com/videos/termodinamica-teoria-11-calculo-de-la-entalpia-de-reaccion-a-partir-de-las-entalpias-de-formacion
QuimiTube, 10 Años Antes
Hola, Muchas gracias por tu ayuda con los videos, son muy buenos.
Saludos.
Jorge, 10 Años Antes
Gracias Jorge, me alegra que te sirvan. Gracias por tu comentario.
QuimiTube, 10 Años Antes
Gracias, me ha ayudado mucho este vídeo.
P.D. Eres muy bonita.
Josué, 10 Años Antes
Muchas gracias Josué y bienvenido.
QuimiTube, 10 Años Antes
Muchas gracias por tus videos, son geniales!
Candela, 10 Años Antes
Hola, yo tengo una pregunta…cuando expresas la entalpía de reacción en kj/mol, se puede entender que se refiere solamente a calor desprendido por cada mol de reactivo o también se aplica a los productos, es decir calor desprendido por mol de producto?
ahilen, 9 Años Antes
Generalmente se aplica a los reactivos, pero puesto que se trata únicamente de una relación matemática también podría aplicarse a los productos de ser necesario, aunque te lo tendrían que especificar… Lo importante es que tengas claro a qué se refiere por si los coeficientes estequiométricos son distintos. Un saludo.
QuimiTube, 9 Años Antes