Contenido del Vídeo
Cuando hablamos de propiedades de un compuesto, principalmente nos referimos a: estado de agregación a temperatura ambiente (puntos de fusión y de ebullición), conductividad eléctrica, dureza y solubilidad en disolventes polares y apolares. Varias de estas propiedades dependen de la fuerza del enlace químico implicado. En el caso del enlace iónico, los iones se hallan unidos fuertemente entre sí, porque las atracciones electrostáticas entre iones de signo opuesto, son intensas. Así, para fundir o evaporar un compuesto iónico, habrá que aportar una gran cantidad de energía, porque será necesario romper las interacciones catión-anión. Esto hace que se requieran temperaturas elevadas.
De forma general, las propiedades de los compuestos iónicos son:
-
- Sólidos a temperatura ambiente. Las fuerzas que mantienen unidos los iones son fuertes, y por este motivo a temperatura ambiente el compuesto se halla en estado sólido.
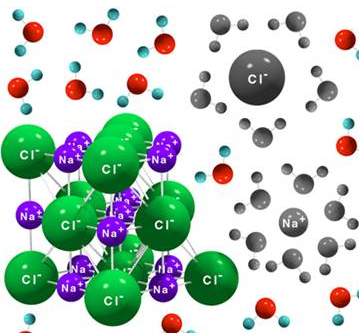
- Forman redes cristalinas altamente ordenadas. Los aniones y cationes tienen posiciones definidas en el espacio, en función del tipo de red cristalina.
- Puntos de fusión y ebullición elevados. Debido a que, como hemos dicho, las fuerzas electrostáticas que mantienen unidos los iones son fuertes, es costoso separarlos. Por este motivo, hay que aportar elevadas temperaturas para fundirlos y para evaporarlos.
- Elevada dureza. También se debe a la fortaleza del enlace, ya que para rayar la superficie del compuesto hay que romper enlaces de los iones superficiales. Sin embargo, podrán ser rayados por compuestos de mayor dureza, como por ejemplo el diamante (el compuesto de mayor dureza, con un 10 en la escala de Mohs).
- Fragilidad. A pesar de su dureza, son frágiles frente a los golpes. ¿Por qué? Porque un impacto puede hacer resbalar unas capas sobre otras y que, de pronto, se vean enfrentados entre sí iones del mismo signo. La repulsión electrostática entre iones del mismo signo fragmenta el cristal.
- No conductores de la corriente en estado sólido. En estado sólido los iones están colocados en posiciones fijas de la red y no presentan movilidad alguna. La falta de movilidad eléctrica hace que no sean conductores.
- Conductores de la corriente eléctrica en estado fundido o disuelto. Puesto que en estado fundido o disuelto los iones ya sí presentan movilidad, a diferencia de lo que ocurre en estado sólido, en estos estados pueden conducir la corriente.
- Insolubles en disolventes apolares.
- Solubles en disolventes polares. Son solubles en disolventes polares como el amoníaco líquido o el agua, pues las moléculas de agua son capaces de rodear los iones y atraerlos electrostáticamente hasta separarlos de la red iónica, fenómeno que se conoce como solvatación. Recordemos que la molécula de agua es un dipolo. Cuanto más estable sea la red, es decir, mayor sea su energía reticular, más difícil será disolverlo porque ser requerirá mayor energía. Por ello, aunque en general digamos que los compuestos iónicos son solubles en agua, algunos de ellos no lo son (por ejemplo, el yoduro de plomo, que en agua precipita tal y como puedes ver aquí).
Disolución del cloruro sódico en agua: vía chemeleon.blogspot.com
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace iónico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
La mejor web de Quimica!
Muy explicadas las propiedades de los compuestos ionicos!
Gracias! 🙂
didi, 11 Años Antes
Gracias a ti por comentar y por darnos tantos ánimos 😀 Así nos cuesta un poquito menos seguir trabajando jejeje. Un saludo enorme, Carmen.
QuimiTube, 11 Años Antes
muy bien! anteriormente me comi el «bien» hi hi hi
didi, 11 Años Antes
Me encanta la forma en la q se ha explicado el tema 🙂
cijo hdz, 11 Años Antes
¡Gracias! Me alegro mucho 🙂
QuimiTube, 11 Años Antes
aprendi mucho
lucas, 11 Años Antes
Gracias Lucas, me alegro 🙂
QuimiTube, 11 Años Antes
muy chida…..me explico muy bien …gracias
elizabeth, 10 Años Antes
De nada, me alegro de que te sirviera. Un saludo.
QuimiTube, 10 Años Antes
Una gran web y una gran explicación. Sin embargo creo que hay un error cerca del minuto ocho. Comentas que las sustancias iónicas son solubles en disolventes polares y después dices que no son solubles en disolventes polares ¿Querías decir apolares?
Por lo demás me ha resultado muy útil. Gracias 🙂
Carlos, 10 Años Antes
Tienes toda la razón Carlos, como soy una persona muy despistada a veces me pasan estas cosas 🙂 Por supuesto quería decir apolares, de hecho luego menciono, por ejemplo, el benceno, claramente apolar. Los compuestos iónicos son solubles en disolventes polares e insolubles en disolventes apolares (espero haberlo dicho bien ahora jajaja). Un saludo muy grande y gracias por comentar.
QuimiTube, 10 Años Antes
Perdona, no había terminado de ver el video antes de comentar antes y no vi la corrección. Ahora si que es perfecto el video 🙂
Carlos, 10 Años Antes
felicitaciones a este web esta bien chido garacias a quimitube me saque un 20 en examen ………….
delsi princesah, 10 Años Antes
Gracias Delsi, me alegro de que te sirvan… ¿Un 20 sobre cuánto? Es por curiosidad, ya que en España se puntúa sobre 10. Un saludo grande.
QuimiTube, 10 Años Antes
Estoy absolutamente encantada desde que descubrí esta web. Con cada nuevo vídeo me asombro más del increíble trabajo que estáis haciendo. Estáis ayudando a un montón de personas (entre ellas a mí) a entender más y mejor la química. Por cuestiones personales me veo obligada a repetir las pruebas de acceso a la universidad para poder retomar la carrera que tengo iniciada y gracias a esta web estoy entendiendo algunos conceptos que hasta el momentos me habían resultado incomprensibles.
Carmen, quería decirte que como docente me pareces espectacular. Te explicas muy bien y tienes la capacidad de hacer que los conceptos parezcan sencillos y asimilables.
Y ahora quería plantearte una duda que lleva un par de días rondándome por la cabeza: Los compuestos no son 100% iónicos o 100% covalentes, ¿no? Es que antes de ver este tema estuve viendo el de redox y ahora, al ver compuestos como el HF el HCl como covalentes, me surge la duda de por qué pueden disociarse en iones al estar en medio acuoso. Es decir, ¿un compuesto covalente puede disociarse en iones? El hecho de que se disocien en iones me hacía pensar que se trataba de compuestos iónicos, pero he visto que las combinaciones del hidrógeno con los halógenos son covalentes. ¿Entonces por qué en redox podemos separar el HCl en iones y no podemos separar el O2 o el MnO? Ésa es la duda.
Gracias y enhorabuena por la web. 🙂
Ana, 10 Años Antes
¡Hola Ana! No te puedes imaginar el «impacto» que me ha causado tu comentario, cuánto te lo agradezco… He tardado un poco más en responderte porque sabía que iba a ser más largo de lo habitual 🙂
Es bonito esforzarte cada día al máximo en algo y ver que ese algo tiene su recompensa, que es la utilidad en los alumnos que lo utilizáis. Yo creo que no hay nada que cause más ilusión que esto a un docente que, como yo, tiene una gran vocación.Mil gracias por comentarlo, y muchísimo ánimo con la prueba de acceso y con la carrera.
En cuanto a tu duda, en efecto, no es posible considerar un enlace como 100% de un tipo (salvo por ejemplo moléculas diatómicas iguales, H2, Cl2… que son 100% covalentes). Ya el hecho de que las diferencias de electronegatividad no sean siempre iguales nos hace pensar que algo tiene que ser distinto en esos enlaces… Lo que ocurre con el HCl o el HF es que en general se consideran covalentes, pero tienen suficiente carácter iónico para disociarse, ya que los iones H+, Cl- y F- son muy estables, y esta estabilidad posibilita la disociación. De hecho, puedes ver el cálculo del carácter iónico de un compuesto en estos vídeos de ejercicios:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-9-calculo-del-porcentaje-de-caracter-ionico-con-el-momento-dipolar-y-la-distancia-de-enlace/
http://www.quimitube.com/videos/enlace-quimico-ejercicio-10-calculo-del-porcentaje-de-caracter-ionico-con-la-diferencia-de-electronegatividades/
En cuanto al caso del MnO2, aunque el enlace sea iónico, se trata de una red con una energía reticular muy grande, tanto, que el agua es incapaz de separar por solvatación los iones de Mn(+4) y O(2-), porque requeriría muchísima energía. Por este motivo el MnO2 es insoluble y lo consideramos como un compuesto completo que precipita en la disolución una vez formado, y no como Mn(+4) y O(2-), pero esto, como te digo, tiene más relación con la solubilidad del compuesto por energía de red que por el tipo de enlace que presente.
Un saludo muy grande,
Carmen
QuimiTube, 10 Años Antes
Saludos.es primera ves que vicito el espacio y Me parece muy bueno en cuanto a la explicación de enlaces iónicos.tendré presente este espacio para realizar investigaciones.. Gracias!!
francis, 7 Años Antes
Hola Francis, muchas gracias por tu comentario y bienvenido. Un saludo.
QuimiTube, 7 Años Antes
jajjajaj extha paginha extha buenixima xa lax recomiendho 😛 :*
maria jose lozano vargas, 10 Años Antes
¡Gracias! 🙂
QuimiTube, 10 Años Antes
¡Gracias por la respuesta y por los ánimos! 🙂
Pienso seguir viendo los vídeos de los temas que me quedan y «acribillándote» a preguntas con todas las dudas que se me ocurran, jijiji.
Un saludo.
Ana, 10 Años Antes
Me parece fenomenal, yo intentaré responderte siempre lo más rápido que pueda. ¿Cuándo te examinas?
Quimitube, 10 Años Antes
Muchas gracias por responder tan rápido.
Tengo los exámenes en nada, 11, 12 y 13 de junio. Aún no estoy del todo segura pero supongo que el de química será el último día.
Tengo una duda sobre un asunto sobre configuraciones electrónicas. ¿Puedo planteártela aquí mismo o mejor en el tema correspondiente?
Ana, 10 Años Antes
Mejor en configuración electrónica, si te parece bien.
QuimiTube, 10 Años Antes
Hooola, nos encanto esta pagina, esta re bien explicada y todo… no encontraba en ningun lugar propiedades de los compuestos ionicos. Graciaaaaaaaaaaasssss son geniaaaleesss<3
Delfina y Sol, 10 Años Antes
Muchas gracias chicas, me alegro mucho de que hayáis encontrado la página y de que os haya gustado. Mucho ánimo con vuestros estudios y un saludo muy grande.
QuimiTube, 10 Años Antes
me parece bien lo k ustedes subem x k ese un bien a los estudiantes
carolina, 10 Años Antes
Muchas gracias Carolina y bienvenida.
QuimiTube, 10 Años Antes
Te acabo de descubrir, que lastima que termine examenes hoy; pero para este verano pienso verme todos los videos; sobretodo los de termodinamica que se me ha atragantado; estoy en tercero de carrera y he de decirte que muchas cosas de las que explicas, los profesores se las saltan o no dan tiempo a asimilar, vente a la uji de profesora jajajja; saludos!
Javier, 10 Años Antes
Hola Javier, vaya panorama te espera jeje, viendo vídeos de quimitube en verano… 🙂 Me alegro de que hayas descubierto la página y de que te sirvan los contenidos. Sí que es cierto que los profesores en la universidad dan muchas cosas por supuestas, en parte por falta de tiempo y en parte para que los alumnos tengan que buscarse un poco la vida por su cuenta… Si me contratan en la uji allá que me voy 🙂
QuimiTube, 10 Años Antes
olas amios viendo y entendiendo esto me saque un 20
cristian, 10 Años Antes
Awwwww…Gracias Me Ayudaste Mucho ..!!!! ♥
angie, 10 Años Antes
De nada Angie, me alegro muchísimo de que te sirviera. Un saludo y bienvenida.
QuimiTube, 10 Años Antes
Muchas Gracias Hermosa Me sirvio Mucho
Santiago Castrillon, 10 Años Antes
¡De nada!
QuimiTube, 10 Años Antes
bien hay eeeeeee termine mi tarea (y)
carmen, 10 Años Antes
Me alegra mucho 🙂
QuimiTube, 10 Años Antes
no entendi yo puse para que me sirve las propiedades de los compuestos ionicos en el futuro y me salio esto y no entiendo:(
lleral, 10 Años Antes
Muchas gracias por la explicación. A parte de explicar muy bien esta muy guapa la maestra 😛 jejeje. En verdad me sirvio mucho al información 😉
Saúl, 10 Años Antes
Excelente informacion me ayudo bastante
Hector Jurado Valerio, 10 Años Antes
Hola muy bien explicado, tengo una duda los compuestos ionicos son electricamente neutros ? 🙂
Richard, 10 Años Antes
muchas gracias, me ha sido de gran ayuda 🙂
amal, 10 Años Antes
De nada, me alegra mucho 🙂
QuimiTube, 10 Años Antes
Me encanto la explicación, muy bien expuesto… al fin pude entender este tema y otros mas! Graciias
Milagros Toro, 10 Años Antes
Muchas gracias Milagros por tomarte tu tiempo para dejar un comentario en la web. Un saludo grande.
QuimiTube, 10 Años Antes
Excelente la explicación.Muy clara .mil gracias!!
andrea, 9 Años Antes
¡Muchas gracias!
QuimiTube, 9 Años Antes
Tanto su sitio web como los video de Youtube me ayudan mucho siempre, ¡mil gracias!
Alexia, 9 Años Antes
¡Muchísimas gracias a ti por tomarte tu tiempo para comentarlo!
QuimiTube, 9 Años Antes
Buena información muchísimas gracias 🙂
aaron, 9 Años Antes
¡Hola! Gracias a ti por comentar, bienvenido.
QuimiTube, 9 Años Antes
me encanto la explicacion
carmen, 9 Años Antes
Muchas gracias Carmen, somos tocayas. Un saludo.
QuimiTube, 9 Años Antes
me gusto mucho la explicacion…entiendo mejor aqui que con mis maestros =)
santy, 9 Años Antes
Hola Santy, me alegra mucho que te haya gustado 🙂 Un saludo grande
QuimiTube, 9 Años Antes
Muy explicito esta este tema me ayuda mucho para mi proximo examen.
Pamela, 9 Años Antes
¡Mucha suerte!
QuimiTube, 9 Años Antes
He amado tus videos. Tus explicaciones son excelentes, claras. En estos días he tenido que volver a estudiar cosas de bachillerato para ingresar a otra universidad (me estoy cambiando) y para química, tus videos me han ayudado como ninguna otra cosa.
Gracias por tomarte el tiempo de hacer estos videos, se nota tu dedicación hacia las personas que quieren aprender.
Solo tengo una duda (perdón que no este relacionada con el tema de este video, pero no se donde más ponerlo), ¿has hecho algún video de clasificación y tipos de las reacciones químicas, y balanceo de ecuaciones? ¿O de estequiometría? Perdona si no los he identificado a simple vista pero tiene tanto tiempo que no veo esos temas que no se si son el tema que busco.
Saludos 🙂
Isaac, 9 Años Antes
Hola Isaac, muchísimas gracias por tu comentario, me alegra que te hayan servido. Mucha suerte con tus estudios universitarios. Sobre balanceo de ecuaciones y estequiometría no tenemos nada, aunque sí que hemos hecho un curso para la plataforma Owlas que en parte te puede servir. Es este: http://www.owlas.com/web/ajuste-de-reacciones-quimicas
Es un curso gratuito.
Un saludo grande
QuimiTube, 9 Años Antes
Muy bueno, estoy en 10 y me sirvió mucho!
Miguel Zuñiga, 9 Años Antes
Muchas gracias Miguel, me alegra que te sirviera. Un saludo.
QuimiTube, 9 Años Antes
Esta pagina esta excelente, es lo mejor que eh visto para aprender química. Un enorme agradecimiento a todos quienes la hacen posible
Ozonoh, 9 Años Antes
¡Muchísimas gracias!
QuimiTube, 9 Años Antes
me sirvio muchisimo la informacion, para citarlo necesito su nombre
gracias
Debora, 9 Años Antes
Hola Débora, el nombre de la profesora es Carmen Caballero. Un saludo.
QuimiTube, 9 Años Antes
Gracias 🙂 muy completa 😀
Tomando nota para mi clase
Saul, 9 Años Antes
De nada, me alegra que te sirviera 🙂 Un saludo grande.
QuimiTube, 9 Años Antes
Hola:
muchas gracias me haz, salvado es un tema que no entendía, gracias a ti ya lo entendí. tienes todo mi respeto.
Roberto Benito, 8 Años Antes
Hola Roberto, me alegra mucho que te haya servido. Un saludo y bienvenido.
QuimiTube, 8 Años Antes
me sirvio de muxa yuda la explicacion gracias
snaider, 8 Años Antes
¡De nada!
QuimiTube, 8 Años Antes
He visto varios ejercicios sobre energia reticular y el ciclo de Born Haber. En los que aparece el Br, no dan los datos de la entalpía de
evaporización y el proceso lo realizan sin ella, ¿Por qué? ¿Consideran el bromo ya en estado gaseoso?
Yolanda Picó, 8 Años Antes
¡Hola! Debe ser esto que comentas, que han considerado que ya estaba en estado gaseoso (quizá te indiquen datos a una temperatura no estándar), pero no es lo suyo. Lo normal es que sí que te den la entalpía de vaporización y como tal la tengas en cuenta, como en este ejercicio:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-29-calculo-de-la-energia-reticular-del-bromuro-potasico-kbr-por-el-ciclo-de-born-haber
QuimiTube, 8 Años Antes
Gracias,Me Ha Sido De Mucha Ayuda Su Explicación Saludos xD
Richard, 8 Años Antes
De nada, gracias a ti por comentar. Un saludo.
QuimiTube, 8 Años Antes
«Te agradesco mucho tu información súper me ayudadte con mi tarea en química la cual me interesa mucho graciassss
Marcela Abril, 8 Años Antes
cuales son las propiedades mecanicas y fisicas de los enlaces ionicos
JAVIER HECTOR APALE JIMENEZ, 8 Años Antes
Quien me ayuda con 5 ejemplos de mayor a menor de cada propiedad
Santiago Ramirez Marin, 8 Años Antes
gracias me sirvio mucho y…. estas guapa 😉
Alan, 8 Años Antes
Gracias, me alegra que te sirviera 🙂
QuimiTube, 8 Años Antes
MuChas gracias tengo prueba de esto en 3 dias y me has ayudado bastante
Joaquin Olguin, 8 Años Antes
Me ayudo bastante gracias
Alexandra, 8 Años Antes
¡De nada! Gracias a ti por comentar.
QuimiTube, 8 Años Antes
gracias me sirvió mucho te lo agradesco
samuel, 8 Años Antes
De nada Samuel, gracias a ti por comentar.
QuimiTube, 8 Años Antes
Muchas gracias por la explicación !!! Mejor explicada imposible, muy fácil de entender 🙂
Damaris, 8 Años Antes
¡Muchas gracias! Un abrazo grande y ánimo con tus estudios.
QuimiTube, 8 Años Antes
Gracias! Es una buena página,me han salvado muchas veces en el curso de quíimica jaja
Jimena, 7 Años Antes
¡Hola Jimena! Me alegra mucho, bienvenida. Un saludo grande.
QuimiTube, 7 Años Antes
ME GUSTO TU EXPLICACION MUCHAS GRACIAS!!!
ANONIMO, 7 Años Antes
De nada, gracias a ti por comentar.
QuimiTube, 7 Años Antes
Hola, entendí muy bien tu explicación. Tengo una duda, cómo puedo comparar la solubilidad de dos compuestos iónicos?
Dhya, 7 Años Antes
¡Hola! A partir de la energía de red del compuesto y de la entalpía de solvatación. Si los iones están unidos muy fuertemente cuesta más separarlos, aunque esta energía necesaria para separarlos se puede compensar si la energía que se desprende cuando los iones se solvatan con agua es muy elevada.
QuimiTube, 7 Años Antes
Hola , una consulta cuando me dicen que el KF tiene un punto de fusion mas alto que el KCl como puedo comprobarlo??? , saludos .
Daniel, 7 Años Antes
¡Hola! Si te dan datos suficientes podrías calcular la energía reticular de ambos compuestos y el que tenga un valor superior tendrá mayor punto de fusión.
QuimiTube, 3 Años Antes
Buenas tardes, me a gustado mucho su explicación acerca del enlace químico,quisiera saber,si no es mucha molestia, que explicase acerca de compuestos de coordinaciòn, con respecto a su nomenclatura sobre complejos de coordinación,y sus diferentes tipos de isomerías que presentan los compuestos.Desde ya,muchas gracias.
Saludos coordiales. Luciana
Lu, 6 Años Antes
¡Hola! Esto que planteas es de un nivel universitario y de momento no tenemos este tipo de contenidos. A ver si más adelante los podemos hacer. Un saludo grande y gracias por comentar.
QuimiTube, 3 Años Antes
Me ha encantado el video. Mañana tengo examen de química y me he aclarado bastante. Solo tengo una pequeña duda… como puedo saber que elemento tiene mayor dureza o punto de fusion (por ejemplo)? Nuestro profesor nos puso un ejercicio en el que nos daban varios compuestos ionicos y nos preguntaba cual tenia mayor punto de fusion y cual mas dureza y como únicos datos nos daba pues la dureza y la temperatura y no se como relacionarlo con la tabla periódica. Muchas gracias por el video!! 🙂
Blanca, 6 Años Antes
¡Hola! Para ello te sugiero ver el vídeo sobre la energía reticular. Cuanto mayor sea la energía reticular de un compuesto iónico mayor será su punto de fusión y, como dicha energía reticular es directamente proporcional a la carga de los iones e inversamente proporcional a la distancia que los separa, a igualdad de cargas tendrá mayor energía reticular el que tenga los iones más pequeños. Por ejemplo, en el caso de KCl y KF el flúor es más pequeño que el cloro (recuerda que el radio iónico es una propiedad que varía con la tabla periódica) y por ello tendrá mayor energía reticular el KF.
QuimiTube, 3 Años Antes
Muy buena explicación de las propiedades de los compuestos químicos, tienes otros videos en los cuales expliques los sólidos totales disueltos y cuáles son los factores que afectan la solubilidad de un compuesto.
Margatits, 5 Años Antes
¡Hola! Sobre sólidos totales disueltos no, pero sobre solubilidad tal vez te interese este: http://www.quimitube.com/videos/reacciones-de-precipitacion-solubilidad-y-producto-de-solubilidad/ y este otro: https://www.quimitube.com/videos/efecto-del-ion-comun-y-efecto-salino/. Un saludo.
QuimiTube, 3 Años Antes
Hola la verdad recien descubro esta pagina..muy bien explicado me cuesta mucho pero cuando encontráis alguien que explique bien claro me volvió el alma al cuerpo muchas gracias
Elvira, 3 Años Antes
De nada Elvira, mucho ánimo.
QuimiTube, 3 Años Antes