Contenido del Vídeo
Como hemos visto en la Introducción al enlace Químico, a principios del siglo XX, Lewis sugirió la llamada regla del octeto, deducida a raíz de la elevada estabilidad que presentan los átomos de los gases nobles, con ocho electrones en su última capa (capa de valencia). Así, Lewis sugirió que los átomos que no son gases nobles se enlazan para alcanzar 8 electrones en su capa de valencia y alcanzar, por tanto, una configuración electrónica muy estable (a excepción del átomo de hidrógeno, cuya última capa estará completa con tan sólo 2 electrones, alcanzando la configuración electrónica del helio, 1s2).
Así, una de las formas en que los átomos pueden alcanzar ocho electrones en su última capa es por compartición de electrones con otros átomos. Esta compartición de un par de electrones (un electrón procedente del átomo A y otro del átomo B) constituye el enlace covalente. Si se comparte únicamente un par de electrones, hablamos de enlace simple. Si se comparten (entre los mismo átomos) dos pares de electrones, hablamos de enlace doble; si se comparten tres pares de electrones, hablamos de enlace triple.
Para la representación del enlace covalente de moléculas sencillas, resulta muy útil utilizar las llamadas estructuras de Lewis o diagramas de Lewis. En dichos diagramas, los electrones de valencia de un elemento químico se dibujan en torno a él como puntos o cruces.
Esto sería en cuanto a elementos químicos independientes. A continuación se muestran algunas estructuras de Lewis para moléculas sencillas, como la molécula de hidrogeno, H2, la de flúor, F2, o la de amoníaco, NH3.
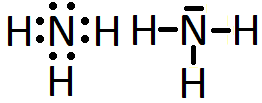
Las líneas que se observan representan, cada una de ellas, un par de electrones, ya sea un par que forma enlace covalente (recibe el nombre de par enlazante) o un par libre o solitaro (par no enlazante) como los que se observan en torno a los átomos de flúor.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente y Estructuras de Lewis.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Me parece muy buenos sus vídeos felicidades pero quisiera saber donde encuentro algún vídeo sobre enlaces ionicos y metalicos
José, 13 Años Antes
Hola José, bienvenido y gracias por las felicitaciones. Lo que sucede es que todavía no está grabado todo el temario; ayer mismo grabé 4 vídeos de enlace iónico y hoy se está subiendo el primero de ellos. Lo enlazaré en la página web lo más pronto posible, seguramente mañana. Un saludo.
QuimiTube, 13 Años Antes
Hola Carne:
Gracias por tu ayuda en el ejercicio del efecto fotoelectriconal final lo tuve bien. 🙂
Una duda puedes hacer un vídeo que explique como se hace cualquier estructura de Lewis,una especie de método, pero de moléculas más complejas un ejemplo de ello es el H2SO4. Es que nos han dicho que es ir probando pero yo así no me aclaro.
Muchas gracias 🙂
Marina, 13 Años Antes
Quería decir Carmen 🙂
Marina, 13 Años Antes
Jajaja, sí, ya me había supuesto que había sido sin querer. Me alegro de que lo tuvieras bien, porque como no nos coincidían mucho los resultados…
Cuando haga los ejercicios resueltos del tema de enlace (aún estoy con la teoría), que espero sea pronto, añadiré algunos de estructuras de Lewis más complejas.
Un saludo,
Carne 😀
Quimitube, 13 Años Antes
Hola feeeeeeooooooosssssss 😛
angie, 10 Años Antes
¡Hola! Acabo de ver el video y está muy bien, pero todavía tengo una duda. Según mi libro de química, la covalencia de un átomo es el número máximo de enlaces covalentes que este puede formar, y viene determinado por el máximo número de electrones desapareados que posee en su capa de valencia. De esta manera, la covalencia de oxígeno es 2, ya que posee dos electrones desapareados en dos orbitales p semiocupados. El otro orbital p se encuentra lleno. Además no puede expandir su octeto dado que no posee orbitales de tipo d. ¿Cómo puede entonces formar un triple enlace con el carbono para dar Monóxido de carbono? Un saludo y gracias =)
Gabriel, 13 Años Antes
¡Hola Gabriel! Bienvenido. En realidad, cuando se plantea el monóxido de carbono con triple enlace, uno de estos enlaces debe ser un enlace dativo, es decir, un enlace en el cual uno de los pares de electrones libres del oxígeno es cedido parcialmente al carbono, por lo que no sería un enlace covalente «normal». Puedes hallar una breve explicación de estos enlaces aquí: http://www.quimitube.com/videos/enlace-covalente-coordinado-o-dativo/
Si miras aquí en wikipedia la estructura de lewis que te plantean, verás que de los tres enlaces uno de ellos viene representado como una flecha.
Gracias por consultar tus dudas 🙂
Un saludo,
Carmen
QuimiTube, 13 Años Antes
¡¡Muchas gracias!! Algo así era lo único que se me ocurría, pero no estaba seguro porque no sabía que entre dos átomos se pueden dar dos tipos de enlace diferentes, es decir, dos covalentes normales y uno dativo a la vez. Gracias por responder! 😉 Por cierto, tengo otra pequeña duda pero es de formulación, si no te importa la pongo aquí porque no veo ningún apartado para ello. ¿Por qué el prefijo numeral del Disulfuro de carbono se puede omitir y se puede nombrar como sulfuro de carbono, si el carbono puede actuar con dos valencias diferentes, la +2 y +4? Saludos!!
Gabriel, 13 Años Antes
¡Hola Gabriel! Lo que ocurre es que cuando el carbono se combina con otro elemento no metálico para formar una sal binaria, como es el caso, actúa únicamente con el estado de oxidación +IV. Por este motivo se puede omitir el e.o. y poner únicamente «sulfuro de carbono», en nomenclatura sistemática. También podríamos emplear la stock e indicarlo, para evitar confusiones: sulfuro de carbono (IV). Lo mismo ocure con otros compuestos como SiC, carburo de silicio o carburo de silicio (IV) (es un carburo y no un siliciuro porque el carbono es más electronegativo).
QuimiTube, 13 Años Antes
¡¡Gracias por la respuesta!! y espero que sigas haciendo fantástivos videos sobre Química 😉
Gabriel, 13 Años Antes
No dejaré de hacerlos pero intentaré mejorar todo lo posible para que sean tan fantásticos como dices 😀 Me divierte y me gusta hacer los vídeos, pero siempre tenemos que avanzar y mejorar un poquito. Un saludo grande.
Quimitube, 13 Años Antes
wahoo que buenas respuestas sobre la funcion de lewis 😀 felicidades
faathyy, 13 Años Antes
Muchas gracias, me alegro de que te sirvan 🙂
QuimiTube, 13 Años Antes
Enhorabuena por la página, es muy completa y me está ayudando mucho.
Sofía, 13 Años Antes
Hola Sofía, bienvenida y gracias, me alegro mucho de que te sirva 🙂
QuimiTube, 13 Años Antes
El lunes tengo un examen de los enlaces químicos y vuestros vídeos me están ayudando muchísimo… Qué suerte he tenido en encontraros 🙂 GRACIAS
Paco, 13 Años Antes
Hola Paco, bienvenido. Yo también me alegro mucho de que nos hayas encontrado jejeje, espero que te sirvan mucho nuestros vídeos. Mucha suerte en tu examen.
QuimiTube, 13 Años Antes
Hola, tengo una duda. ¿Cuántos enlaces forma un átomo? ¿Tantos como electrones desapareados tenga (o tantos como electrones le falten para alcanzar los 8 en la capa de valencia? Gracias.
David, 12 Años Antes
Hola David, bienvenido. Depende del tipo de enlace que forme. Si consideras el enlace covalente, la capacidad para formar enlaces dependerá de los electrones desapareados, por eso puede tener distintas covalentes, como ocurre por ejemplo con el cloro. Para ver esto te recomiendo este ejercicio:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-11-determinacion-de-la-covalencia-de-fluor-cloro-nitrogeno-y-fosforo/
En cuanto a los electrones que le falten o le «sobren» para tener completa la última capa es algo más relacionado con el enlace iónico, quedando los átomos como cationes cuando pierden electrones y como aniones cuando los captan.
QuimiTube, 12 Años Antes
Hola! Tengo una pregunta, ¿la unión de orbitales y el diagrama de lewis es lo mismo? En un ejercicio me piden las dos cosas para la molécula N2. Muchas Gracias!
Nikaly, 12 Años Antes
¡Hola Nikaly! No es exactamente lo mismo pero para establecer cómo se unen los orbitales es conveniente que primero determines la estructura de Lewis. Después lo que te piden es qué orbitales forman los enlaces, por ejemplo en el nitrógeno que tienes enlace triple, habrá un enlace sigma y dos enlaces pi formados por orbitales híbridos sp y por orbitales p puros respectivamente.
QuimiTube, 12 Años Antes
me encanta esta blusa! 😉
Dayana, 12 Años Antes
Jajaja, es mi segundo gatito de Schrödinger.
QuimiTube, 12 Años Antes
Hola, quisiera que me ayudaran con la siguiente estructura de Lewis: CaSO3. Mi pregunta es: es posible que el calcio done un electrón a uno de los oxígenos y otro electrón al otro? Y aquí también habría un enlace dativo entre el azufre y uno de los oxígenos?
Gracias
Karol, 12 Años Antes
¡Hola! Lo que ocurre es que las estructuras de Lewis son para moléculas o iones covalentes. El CaSO3 es un compuesto iónico, formado por iones Ca2+ y por iones SO3(2-). De este modo sólo puedes hacer la estructura de Lewis del anión, el SO3(2-), porque el azufre y los oxígenos sí que se unirán de forma covalente. Puedes ver este vídeo para saber cómo escribir la estructura de Lewis de dicho anión:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-7-estructuras-de-lewis-de-aniones-hipocloroso-nitrito-nitrato-sulfito-carbonato-y-sulfato/
QuimiTube, 12 Años Antes
si puede me anda su correo…
dirmer, 12 Años Antes
Lo tienes aquí mismo en formulario de contacto, quimitube@gmail.com, pero si es para dudas relacionadas con un ejercicio te las responderemos en los comentarios de los vídeos, para que puedan servir para otros usuarios. Un saludo.
QuimiTube, 12 Años Antes
Hola, amigos de Quimitube…soy Pedro de Córdoba, Argentina y los quiero felicitar por crear este espacio virtual de divulgación de la Química. Desde ya que los tomo como sitio de referencia y consulta ya que soy profesor en un instituto de formación de docentes para la educación secundaria en Química y en Biología.
También, porque no, ofrecer una mirada colaborativa.
Mis mejores deseos para este proyecto.
Un saludo desde Argentina.
Juan Pedro Mainero, 12 Años Antes
Hola Juan Pedro, bienvenido. Muchas gracias por tu apoyo, resulta muy especial viniendo de una persona que se dedica a la formación de docentes, que es un escalón muy alto en la docencia. Gracias nuevamente por el comentario y por supuesto, siempre podemos colaborar de algún modo. Un saludo muy grande.
QuimiTube, 12 Años Antes
Felicidades por tus videos, ayudan muchisimo!!! tengo una duda, los puntitos que yo marco alrededor del elemento tienen un orden especifico o se ponen al azar? por ejemplo si tengo 5 electrones en la capa de valencia, yo pondria los puntitos uno por uno, sería arriba,derecha, abajo, izquierda, arrriba??? o en ves de poner dos puntitos arriba, los puedo poner a la derecha, abajo o a la izquierda??? graciasss
Ricardo, 12 Años Antes
¡Hola Ricardo! Gracias por tu comentario 🙂 No tiene importancia cómo los coloques porque en realidad los electrones no están ni así ni asá, simplemente en constante movimiento, y dibujarlos es un artificio que a nosotros nos sirve como representación, pero no es real. Mientras pongas el número correcto, estará bien. Un saludo.
QuimiTube, 12 Años Antes
Hola Carmen! Muchas felicitaciones por tus videos, son de gran untilidad y ademas que son faciles de entender. Gracias a ti ya no odio tanto quimica jeje. Eres muy buena profesora y muy linda tambien.
Hugo Valle, 12 Años Antes
Hola queria desirles que no entiendo las estructuras de lewis de las uniones ionicas me prodrias esplicar ?
Gusavo, 12 Años Antes
Hola Gustavo, las estructuras de Lewis solo se aplican a compuestos covalentes, no a compuestos iónicos.
QuimiTube, 12 Años Antes
la verdad si m parecio estupendo
oscar fernando, 12 Años Antes
las estructuras de lewis de la siguiente union covalente
o p o h
o
como se realiza
Gustavo, 12 Años Antes
Hola Gustavo, te sugiero que veas los ejercicios resueltos de estructuras de Lewis que encontrarás aquí:
http://www.quimitube.com/ejercicios-de-enlace-quimico/
Son los ejercicios del 4 al 8. Un saludo.
QuimiTube, 12 Años Antes
Hola, vi el vídeo pero no entiendo cuando recibe, comparte o cede
Danna, 5 Años Antes
Hola Danna, en este vídeo hablamos de enlace covalente. En el enlace covalente siempre comparten electrones, no ceden ni reciben. El enlace covalente se basa, de hecho, en la compartición de pares electrónicos.
QuimiTube, 5 Años Antes
Este video esta muy bien y muy bien hecho, no entendia como se formaban los enlaces covalentes y gracias a este vide aprobaré el examen. (:
Quasimodo, 12 Años Antes
Me alegra mucho, suerte con tu examen.
QuimiTube, 12 Años Antes
no entendi lo tipos de enlace covalente?
LoOL, 12 Años Antes
Esencialmente tienes dos, el enlace covalente «normal», o enlace covalente en sí mismo (compartición de un par de electrones en el que cada átomo del enlace aporta un electrón) y enlace covalente coordinado o dativo (en el que los dos electrones son aportados por el mismo átomo).
QuimiTube, 12 Años Antes
todos los atomos que participan de uniones covalentes completan el octeto?..por que?
solange, 12 Años Antes
¡Hola! Generalmente sí, al menos los del segundo período, porque la configuración electrónica de 8 electrones en la última capa es la que tienen los gases nobles y es muy estable. Sin embargo, existen excepciones: http://www.quimitube.com/videos/enlace-covalente-excepciones-a-la-regla-del-octeto/
QuimiTube, 12 Años Antes
hola.tengo una consulta para resolver enlaces covalentes hacemos esta formula C=N-D como se hace para poder calcularlo..gracias
belen, 11 Años Antes
Hola Belén, lo siento, no sé a qué se refiere esa fórmula si no me especificas un poco más, es posible que sea algo interno de tu escuela… Un saludo.
QuimiTube, 11 Años Antes
la verdad me libraron de que mi maestra me ragañra por no hacer la tarea jejjee muy buen video la verdad sigan asi
sergio, 11 Años Antes
Buenas noches, muy interesantes tus videos. Tengo algunas preguntas sobre la estructura de Lewis. Cuando estudié este tema hace varios años atrás al dibujar Lewis para el H2SO4 nos explicaron que el asufre por ser un anfígeno máximo puede formar dos enlaces (más de 2 debe ser dativo), teniendo en la estructura dos enlaces simples y dos dativos, pero ahora que he vuelto a revisar observo estrcuturas con simples y dobles enlaces (no veo ya dativos) y mi sorpresa fue el doble enlace. Además quisiera saber cuando con seguridad puedo aplicar la regla del N-D, se que existen varias excepciones a la regla del octeto.
Isaac, 11 Años Antes
Hola Isaac, es cierto que en ocasiones se indica la estructura de algunos oxoácidos con enlaces dativos, pero yo prefiero plantearlo con enlaces simples y dobles porque resulta más fácil el planteamiento, y debemos tener en cuenta que las estructuras de Lewis no son más que una representación de la molécula que nos sirve para algunos fines como predecir la geometría de la misma, pero no es algo rígido, digamos que no es real. El azufre es, de hecho, uno de los elementos que consideramos dentro de las excepciones a la regla del octeto. Tienes algunos átomos que presentan excepción por exceso (azufre, fósforo) y otros por defecto (boro, berilio). Lo verás mejor en este vídeo:
http://www.quimitube.com/videos/enlace-covalente-excepciones-a-la-regla-del-octeto
QuimiTube, 11 Años Antes
¿cual es la estructura de lewis del atomo y del ion ´para el calcio?
anonimo, 11 Años Antes
¡Hola! No acabo de entender bien la pregunta, ¿te refieres al átomo de calcio neutro y al Ca2+? En el caso de los metales normalmente no se escriben estructuras de Lewis porque dichas estructuras son para enlaces covalentes, que los metales no forman. Un saludo.
QuimiTube, 11 Años Antes
oye sigo teniendo dudas de este video decovalentes 😀
amaranta, 11 Años Antes
¡Hola! Te sugiero que veas el vídeo sobre las excepciones:
http://www.quimitube.com/videos/enlace-covalente-excepciones-a-la-regla-del-octeto
Y en general todo lo relativo a estructuras de Lewis:
http://www.quimitube.com/videostags/estructuras-de-lewis
Ten en cuenta que en Quimitube no hacemos vídeos sueltos, todos forman parte de apartados de temas completos, como los apartados de un libro. Aquí tienes todo lo que hay de enlace covalente:
http://www.quimitube.com/videostags/enlace-covalente
Lo más adecuado es ver el tema de enlace químico completo y en orden:
http://www.quimitube.com/videoscategory/enlace-quimico
El esfuerzo merece la pena para sacar buena nota.
Un saludo
QuimiTube, 11 Años Antes
Hola, yo tengo una pequeña duda, como puedo hacer un enlace covalente de carbono? Es una tarea que me pidieron y necesito saberlo urgente, saludos. 🙂
Juan, 11 Años Antes
Hola Juan, los enlaces covalentes en el carbono dan lugar a multitud de compuestos, por ejemplo el grafito o el diamante:
http://www.quimitube.com/videos/propiedades-de-las-redes-covalentes-estructuras-del-diamante-y-del-grafito
O también otros compuestos como el etano:
http://www.quimitube.com/videos/modelo-del-enlace-de-valencia-hibridacion-sp3-del-metano-y-el-etano
QuimiTube, 11 Años Antes
hola buenas noches. Estoy haciendo repasando para febrero, estoy viendo uniones quimicas, covalentes y me dieron un ejercicio un poco dificiles. quisiera saber como se hace y como se separarian porque me estoy volviendo loca.
ejercicios : I2 O7 y el otro N4 O5
gracias, saludos!!
constanza, 10 Años Antes
¡Hola! Aunque sean más sencillos, has visto estos vídeos?
http://www.quimitube.com/videos/ejercicio-enlace-quimico-4-estructuras-de-lewis-de-algunas-moleculas-covalentes-sencillas-sin-resonancia
http://www.quimitube.com/videostags/estructuras-de-lewis
Un saludo y ánimo
QuimiTube, 10 Años Antes
quiero saber el sistema de lewis de esto: ALNO3.. ME URGE .GRACIAS..
annette, 10 Años Antes
Hola Annette, creo que te referías a AgNO3 por estequiometría. Es un compuesto iónico, solo puedes plantear la estructura de Lewis de NO3- que sí que tiene enlace covalente.
QuimiTube, 10 Años Antes
Muchas gracias me encanta tu pagina y tu canal este es mi primer año de universidad, y gracias a tu canal puedo ayudarme en muchos contenidos, seguí asi saludos desde argentina.
ansh, 10 Años Antes
¡Hola! Mil gracias por tu comentario y mucha suerte con tu primer año de universidad. Un saludo grande hasta Argentina.
QuimiTube, 10 Años Antes
Buenos días y gracias por tomarte el tiempo de subir los videos, son de gran ayuda.
Tenia una pregunta con respecto al elemento Al2, con la denominacion «elemento quimico independiente» quiere decir que no esta compartiendo ni cediendo electrones a ningun otro elemento, verdad? Entonces por lo tanto, no forma parte de ninguna unión quimica?
Mariana, 10 Años Antes
Hola Mariana, efectivamente hacemos referencia a que se trata de un átomo solo, que no está unido a ningún otro átomo. Un saludo.
QuimiTube, 10 Años Antes
Hola Carmen, soy una alumna de 4º de ESO a la que tus vídeos le están viniendo de maravilla. Pero aún así tengo una duda muy importante, ¿cómo sé dónde colocar los puntos de la estructura de Lewis?
H* es así, pero, ¿por qué no valdría colocar el punto en la zona inferior izda. H. por ejemplo?
O en el Flúor, ¿ por qué dejas libre el hueco de abajo a la derecha y no otro cualquiera?
Muchísimas gracias y muchos ánimos para seguir con los vídeos.
Ana Isabel, 10 Años Antes
¡Hola Ana Isabel! Efectivamente no hay absolutamente nada que nos diga dónde colocar el electrón, simplemente porque esto es una representación irreal. La realidad es que el electrón está girando de forma caótica en torno al núcleo, no está ni en la izquierda, ni en la derecha… Así, no hay nada de malo en que tú coloques el electrón donde prefieras, en cualquier lugar, porque no es más que eso, una representación de un átomo con sus electrones de valencia. Se suele colocar por ejemplo H* por costumbre, lo cual no implica que si pusieses *H estuviese mal. Algún hueco ha de quedarnos, pero en realidad no importa dónde. Un saludo grande y ánimo con tus estudios.
QuimiTube, 10 Años Antes
[IO4]-3 se puede hacer? o no comple con las reglas, a mi me queda en el aire un O
josue, 10 Años Antes
Efectivamente lo que ocurre es que el yodo no cumple la regla del octeto y por tanto puedes tener más electrones, quedándote con 10 en la última capa, 4 enlaces con los oxígenos y un par libre.
QuimiTube, 10 Años Antes
Hola, tengo una duda, el hidrógeno gaseoso puede tener distintas estructuras de resonancia? Muchas gracias
Brenda, 10 Años Antes
Hola Brenda, no, cada hidrógeno solo tiene un electrón, tu única opción es H-H. Un saludo.
QuimiTube, 10 Años Antes
una pregunta como seria esto
¿dado las siguientes sustancias químicas indicar quien tiene enlace ionico
a)p4 B)HNO3
C)AgNO3 d)C12 H22 O11 e)BeCl2
f)ALCL3
daniel, 10 Años Antes
como se resuelve aa la respuesta gracias pero de resolver como seria mi profesor no enseño 🙁 dijo que todo es leyendo
daniel, 10 Años Antes
Hola Daniel, no entiendo bien tu pregunta, ¿cuál es la respuesta que necesitas?
QuimiTube, 10 Años Antes
Hola Daniel, el enlace iónico se suele dar en compuestos que tienen metales y no metales, con diferencias de electronegatividad grandes, superiores a 1,7. Si el compuesto no es binario (es decir, está formado por más de 2 tipos distintos de átomos) es más difícil de ver, pero será iónico cuando tengas una sal, por ejemplo el AgNO3 es una sal formada por el catión plata, Ag+ y el anión nitrato, NO3-, y sería un compuesto iónico.
Te sugiero que veas también los vídeos sobre enlace iónico.
Un saludo.
QuimiTube, 10 Años Antes
hola
¿se puede hacer lewis en un enlace ionico?
muchas gracias por el video me sirvió
victor, 9 Años Antes
Hola! No, no tiene sentido hacer Lewis de un enlace iónico, es únicamente para enlaces covalentes. Un saludo.
QuimiTube, 9 Años Antes
Hola Profe. necesito su ayuda. en la estructura de lewis de F2 cada atomo de fluor aporta un electron a la union y en la estructura de N2 cada atomo comparte 3 electrones. ahora el proble. cuando valla a rendir como hago para darme cuenta si los puntitos los escribo como que estan compartidos o cada uno se entregan un electron
Mauro, 9 Años Antes
Hola Mauro, tienes que tener en cuenta que cada átomo tiene que tener a su alrededor 8 electrones, contando los de los enlaces. Si el nitrógeno tiene 5 electrones de valencia, tendrá que formar 3 enlaces para conseguir tener 8 electrones (haces la resta 8-5) mientras que si el flúor tiene 7 electrones de valencia solo necesita 1 para tener 8 y por tanto forma 1 enlace. Es decir, tienes que fijarte en cuántos electrones le faltan en la última capa para llegar a 8. Espero que te haya servido esta respuesta. Un saludo y suerte.
QuimiTube, 9 Años Antes
EXELENTE EXPLICACION, COMO TODOS TUS VIDEOS, HASTA PARA MI, QUE DESPUES DE MAS DE 25 AÑOS, EMPEZE A ESTUDIAR DE NUEVO. ME ESTAS AYUDANDO, MONTON CON MIS ESTUDIOS A DISTANCIA, GRACIAS.
Zenia Yanet BASTOS COSTA, 9 Años Antes
¡Hola! Muchas gracias por comentar, me alegra mucho que te sirvan 🙂 ¡Ánimo con tus estudios! A distancia es muy duro pero con fuerza de voluntad lo lograrás. Un abrazo.
QuimiTube, 9 Años Antes