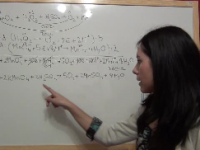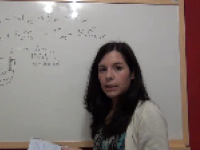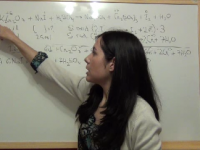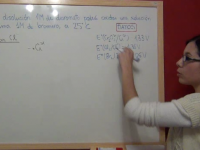-

Ejercicio Química Selectividad PAU (junio 2014, Madrid): Valoración redox entre el peróxido de hidrógeno y el permanganato de potasio
Ejercicio resuelto de química de selectividad de Madrid, de junio de 2014. Es una valoración redox entre el peróxido de hidrógeno y el permanganato de potasio. Ver video -

Ejercicio Química Selectividad PAU (junio 2014, Madrid): oxidación reducción plata y cadmio
Vídeo del ejercicio resuelto de química de selectividad de la comunidad autónoma de Madrid, del examen de junio de 2014. Se trata de un ejercicio de redox. Ver video -

Ejercicio Química Selectividad PAU (junio 2013, Madrid): reacción rédox del sulfuro de cobre (II) y el ácido nítrico
En este vídeo resolveremos un ejercicio de química de selectividad de Madrid, de junio de 2013. Se trata de un ejercicio de oxidación reducción. Ver video -

Ejercicio Redox 1: Ejemplos de determinación del número de oxidación de los átomos de algunos compuestos
En este ejercicio redox resuelto determinaremos el número de oxidación o estado de oxidación de algunos compuestos basándonos en las normas establecidas. Ver video -

Ejercicio Redox 2: uso del número de oxidación para saber qué elemento se reduce y qué elemento se oxida
Usaremos el número de oxidación o estado de oxidación para determinar qué especie se está oxidando y qué especie se está reduciendo. Ver video -

Ejercicio 3: Ajuste de la reacción redox en medio ácido entre el cobre, Cu, y el ácido nítrico, HNO3, con NO como producto
En este ejercicios ajustaremos una reacción de oxidación reducción en medio ácido entre el cobre metálico y el ácido nítrico, produciéndose NO. Ver video -

Ejercicio 4: Ajuste reacción redox en medio ácido Cu + HNO3 en la que se obtiene NO2 como producto
En este ejercicio ajustaremos la reacción de oxidación reducción en medio ácido entre el cobre y el ácido nítrico en la que se produce NO2. Ver video -

Ejercicio 5: Ajuste reacción redox medio ácido de cobre con nítrico, con dos productos de reducción: NO y NO2
En este ejercicio ajustaremos la reacción de cobre con ácido nítrico, pero con una particularidad: se producen dos productos de reducción, NO y NO2. Ver video -

Ejercicio 6: Ajuste de la reacción redox en medio ácido del I2 con HNO3
En este ejercicios ajustaremos la reacción de oxidación reducción en medio ácido que se da entre el yodo, I2, y el ácido nítrico, HNO3. Ver video